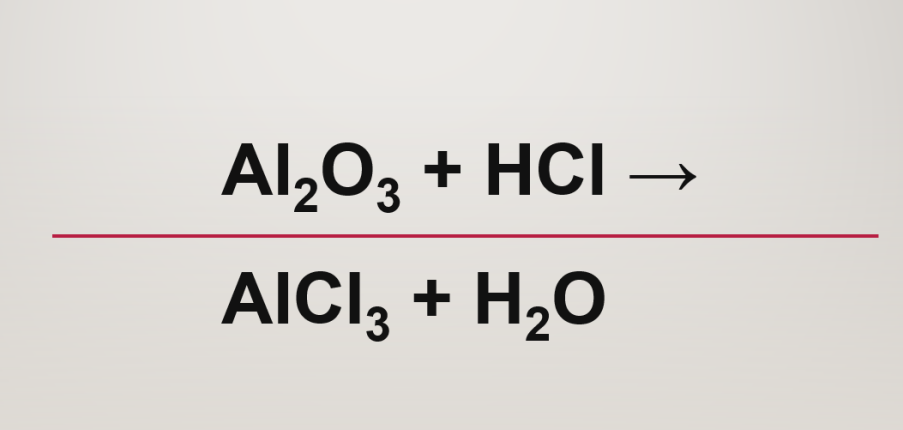Phương trình Al2O3 + 6HCl → 2AlCl3 + 3H2O
1. Phương trình phản ứng Al2O3 tác dụng với HCl
Al2O3 + 6HCl → 2AlCl3 + 3H2O
2. Hiện tượng của phản ứng Al2O3 tác dụng với HCl
Chất rắn màu trắng Al2O3 tan dần tạo dung dịch trong suốt.
3. Cách tiến hành phản ứng Al2O3 tác dụng với HCl
Nhỏ từ từ dung dịch HCl loãng vào ống nghiệm có chứa Al2O3.
4. Cách viết phương trình ion thu gọn của phản ứng Al2O3 tác dụng với HCl
Bước 1: Viết phương trình phân tử:
Al2O3 + 6HCl → 2AlCl3 + 3H2O
Bước 2: Viết phương trình ion đầy đủ bằng cách: chuyển các chất vừa dễ tan, vừa điện li mạnh thành ion; các chất điện li yếu, chất kết tủa, chất khí để nguyên dưới dạng phân tử:
Al2O3+6H++6Cl−→2Al3++6Cl−+3H2O
Bước 3: Viết phương trình ion thu gọn từ phương trình ion đầy đủ bằng cách lược bỏ đi các ion giống nhau ở cả hai vế:
Al2O3+6H+→2Al3++3H2O
5. Mở rộng về nhôm oxit: Al2O3
5.1. Tính chất vật lý
Nhôm oxit là chất rắn màu trắng, không tan trong nước, không tác dụng với nước, nóng chảy ở nhiệt độ trên 2050oC.
5.2. Tính chất hóa học
Nhôm oxit là oxit lưỡng tính, vừa tác dụng với dung dịch axit, vừa tác dụng với dung dịch kiềm.
Al2O3 + 2NaOH → 2NaAlO2 + H2O
Al2O3 + 6HCl → 2AlCl3 + 3H2O
5.3. Ứng dụng
Trong tự nhiên, nhôm oxit tồn tại cả ở dạng ngậm nước và dạng khan.
- Dạng oxit ngậm nước là thành phần chủ yếu của quặng boxit dùng để sản xuất nhôm.
- Dạng oxit khan, có cấu tạo tinh thể là đá quý được dùng làm đồ trang sức, chế tạo đá mài …
- Bột nhôm oxit dùng trong công nghiệp sản xuất chất xúc tác cho tổng hợp hữu cơ.
6. Mở rộng về axit clohiđric
6.1. Tính chất vật lí
- Hiđro clorua tan vào nước tạo thành dung dịch axit clohiđric.
- Axit clohiđric là chất lỏng, không màu, mùi xốc.
- Dung dịch HCl đặc nhất (ở 20oC) đạt tới nồng độ 37% và có khối lượng riêng D = 1,19 g/cm3.
- Dung dịch HCl đặc “bốc khói” trong không khí ẩm. Đó là do hiđro clorua thoát ra tạo với hơi nước trong không khí thành những hạt dung dịch nhỏ như sương mù.
6.2. Tính chất hóa học
Axit clohiđric là một axit mạnh, mang đầy đủ tính chất hóa học của một axit như:
- Làm quỳ tím chuyển sang màu đỏ.
- Tác dụng với kim loại đứng trước (H) trong dãy hoạt động hóa học của kim loại. Ví dụ:
Mg + 2HCl → MgCl2 + H2
2Al + 6HCl → 2AlCl3 + 3H2
Chú ý: Kim loại có nhiều hóa trị tác dụng với dung dịch HCl thu được muối trong đó kim loại ở mức hóa trị thấp. Ví dụ:
Fe + 2HCl → FeCl2 + H2
- Tác dụng với oxit bazơ và bazơ tạo thành muối và nước. Ví dụ:
CuO + 2HCl t0→ CuCl2 + H2O
Fe2O3 + 6HCl t0→ 2FeCl3 + 3H2O
NaOH + HCl → NaCl + H2O
Cu(OH)2 + 2HCl → CuCl2 + 2H2O
- Tác dụng với muối của axit yếu hơn tạo thành muối mới và axit mới. Ví dụ:
CaCO3 + 2HCl → CaCl2 + H2O + CO2 ↑
AgNO3 + HCl → AgCl↓ + HNO3
Ngoài tính chất đặc trưng là tính axit, dung dịch axit HCl đặc còn thể hiện tính khử khi tác dụng chất oxi hoá mạnh như KMnO4, MnO2, K2Cr2O7, MnO2, KClO3…
4H−1Cl+MnO2to→MnCl2+0Cl2+2H2O
K2Cr2O7+14H−1Cl→30Cl2+2KCl+2CrCl3+7H2O
6.3. Điều chế
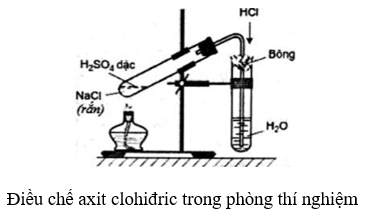
Trong phòng thí nghiệm
- Điều chế hiđro clorua bằng cách cho tinh thể NaCl vào dung dịch H2SO4 đậm đặc và đun nóng (phương pháp sunfat) rồi hấp thụ vào nước để được axit clohiđric.
- Phương trình hóa học minh họa:
2NaCltt + H2SO4 đặc t0≥400o→ Na2SO4 + 2HCl ↑
NaCltt + H2SO4 đặc t0≤250o→ NaHSO4 + HCl ↑
Trong công nghiệp
- Phương pháp tổng hợp: Đốt H2 trong khí quyển Cl2
H2 + Cl2 t0→ 2HCl
- Phương pháp sunfat: Công nghệ sản xuất từ NaCl rắn và H2SO4 đặc:
2NaCltt + H2SO4 đặc t0≥400o→ Na2SO4 + 2HCl ↑
- Ngoài ra một lượng lớn HCl thu được trong công nghiệp từ quá trình clo hóa các hợp chất hữu cơ.
7. Bài tập vận dụng liên quan
Câu 1: Nồng độ cao nhất của dung dịch HCl ở 200C là
A. 25%
B. 37%
C. 20%
D. 50%
Hướng dẫn giải
Đáp án B
Nồng độ cao nhất của dung dịch HCl ở 200C là 37%
Câu 2. Cho 36,5 gam dung dịch HCl 10% vào một cốc đựng NaHCO3 dư thì thu được V lit khí ở đktc. Giá trị của x là
A. 44,8. B. 4,48. C. 22,4. D. 2,24.
Hướng dẫn giải
Đáp án D
nHCl=36,5.10100.36,5=0,1mol
NaHCO3 + HCl → NaCl + H2O + CO2
0,1 0,1 mol
⇒ V = 0,1.22,4 = 2,24 lít.
Câu 3: Kim loại nào sau đây khi tác dụng với HCl và Clo cho cùng một muối clorua kim loại:
A. Cu
B. Ag
C. Fe
D. Zn
Hướng dẫn giải
Đáp án D
Cu, Ag không tác dụng được với HCl → loại A và B.
Fe có hóa trị II và III, khi tác dụng với HCl cho FeCl2 còn tác dụng với Cl2 cho FeCl3 → loại C
Zn tác dụng với Cl2 và HCl đều cho ZnCl2.
Câu 4: Điều chế Cl2 từ HCl và MnO2. Cho toàn bộ khí Cl2 điều chế được qua dung dịch NaI, sau phản ứng thấy có 12,7 gam I2 sinh ra. Khối lượng HCl có trong dung dịch đã dùng là:
A. 9,1 gam
B. 8,3 gam
C. 7,3 gam
D. 12,5 gam
Hướng dẫn giải
Đáp án C
nI2=0,05mol
Theo PTHH: Cl2 + 2 NaI → 2 NaCl + I2
nCl2=nI2=0,05mol
Theo PTHH: MnO2 + 4HCl to→ MnCl2 + 2H2O +Cl2
→nHCl=4nCl2 = 0,05.4 = 0,2 mol
→ m HCl = 0,2. 36,5 = 7,3 g
Câu 5: Cho 36 gam FeO phản ứng vừa đủ với dung dịch chứa a mol HCl. Giá trị của a là
A. 1,00.
B. 0,50.
C. 0,75.
D. 1,25.
Hướng dẫn giải
Đáp án A
nFeO=3672=0,5mol
2HCl + FeO → FeCl2 + H2O
Theo PTHH: nHCl = 2nFeO = 1 mol
Câu 6: Axit HCl có thể tác dụng được với bao nhiêu chất trong dãy sau: Al, Mg(OH)2, Na2SO4, FeS, Fe2O3, K2O, CaCO3, Mg(NO3)2?
A. 6
B. 7
C. 8
D. 9
Hướng dẫn giải
Đáp án A
6 HCl +2 Al → 2AlCl3 + 3H2
2 HCl + Mg(OH)2 → MgCl2 + 2 H2O
2 HCl + FeS → FeCl2 + H2S
6 HCl + Fe2O3 → 2 FeCl3 + 3 H2O
2 HCl + K2O → 2 KCl + H2O
2 HCl + CaCO3 → CaCl2 + H2O + CO2
Xem thêm các phương trình hóa học hay khác:
Al2O3 + H2SO4 → Al2(SO4)3 +H2O | Al2O3 ra Al2(SO4)3
Al2O3 + NaOH → NaAlO2 + H2O | Al2O3 ra NaAlO2