Phản ứng Al + O2 → Al2O3
1. Phương trình phản ứng thí nghiệm Al ra Al2O3
4Al + 3O2 2Al2O3
2. Điều kiện thí nghiệm nhôm tác dụng với oxi
Nhiệt độ
3. Hiện tượng nhôm tác dụng với oxi
Hiện tượng: Có những hạt loé sáng do bột nhôm tác dụng với oxi, phản ứng toả nhiều nhiệt.
Chất tạo thành màu trắng sáng là nhôm oxit Al2O3.
Giải thích: Vì ở điều kiện nhiệt độ này xảy ra phản ứng nhôm tác dụng với oxi trong không khí.
Trong phản ứng hóa học: nhôm đóng vai trò là chất khử.
4. Tính chất hóa học của nhôm
4.1. Tính chất vật lí của nhôm
- Nhôm là kim loại nhẹ (khối lượng riêng 2,7g/cm3).
- Màu trắng bạc, nóng chảy ở nhiệt độ không cao lắm (660oC).
- Nhôm mềm, dễ kéo sợi và dễ dát mỏng.
- Nhôm dẫn điện và dẫn nhiệt tốt.
4.2. Nhận biết nhôm
Cho Al phản ứng với dung dịch NaOH (hoặc KOH). Hiện tượng quan sát được: Nhôm tan dần, sinh ra khí không màu.
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑
4.3. Tính chất hóa học của nhôm
- Tác dụng với oxi và một số phi kim.
4Al + 3O2→ 2Al2O3
Ở điều kiện thường, nhôm phản ứng với oxi tạo thành lớp Al2O3 mỏng bền vững, lớp oxit này bảo vệ đồ vật bằng nhôm, không cho nhôm tác dụng oxi trong không khí, nước.
2Al + 3Cl2 → 2AlCl3
- Tác dụng với axit (HCl, H2SO4 loãng,..)
2Al + 6HCl → 2AlCl3 + 3H2
Chú ý: Nhôm không tác dụng với H2SO4, HNO3 đặc, nguội
- Tác dụng với axit có tính oxi hóa mạnh như HNO3 hoặc H2SO4 đậm đặc
Al + 4HNO3→ Al(NO3)3 + NO + 2H2O
Al + 6HNO3 → Al(NO3)3 + 3NO2 + 3H2O
2Al + 6H2SO4 → Al2(SO4)3 + 3SO2 + 6H2O
- Tác dụng với dung dịch muối của kim loại yếu hơn.
AI + 3AgNO3 → Al(NO3)3 + 3Ag
2Al + 3FeSO4 → Al2(SO4)3 + 3Fe
- Tính chất hóa học riêng của nhôm.
Do lớp oxit nhôm bị hòa tan trong kiềm nên nhôm phản ứng với dung dịch kiềm.
2Al + 2H2O + 2NaOH → 2NaAlO2+ 3H2↑
- Phản ứng nhiệt nhôm
Phản ứng nhiệt nhôm là phản ứng hóa học toả nhiệt trong đó nhôm là chất khử ở nhiệt độ cao.
Ví dụ nổi bật nhất là phản ứng nhiệt nhôm giữa oxit sắt III và nhôm:
Fe2O3+ 2Al → 2Fe + Al2O3
Một số phản ứng khác như:
3CuO+ 2Al → Al2O3 + 3Cu
8Al + 3Fe3O4 → 4Al2O3 + 9Fe
Cr2O3 + 2Al→ Al2O3 + 2Cr
5. Bài tập vận dụng liên quan
Câu 1. Cách nào sau đây không phá hủy các đồ dung bằng nhôm?
A. Dùng nước chanh để làm sạch bề mặt bằng nhôm
B. Rửa sach, lau khô và để chỗ khô ráo
C. Dùng đồ làm bằng nhôm để đựng nước vôi
D. Dùng đồ làm bằng nhôm để đựng nước biển
Lời giải:
B. Rửa sạch, lau khô và để chỗ khô ráo
A, C, D là làm ăn mòn đồ nhôm
Câu 2. Có 3 kim loại Al, Ca, Mg. Chỉ cần dùng thuốc thử nào sau đây có thể nhận ra từng kim loại?
A. dung dịch H2SO4
B. Dung dịch Ba(OH)2
C. Nước
D. dung dịch HCl
Lời giải:
Để phân biệt 3 kim loại Al, Ca, Mg ta dùng nước. Cho nước vào 3 mẫu kim loại, kim loại tốt trong nước và sủi bọt khí là Ca, 2 kim loại không tan trong nước là Al và Mg.
Ca + 2H2O → Ca(OH)2 + H2 ↑
Lấy dung dịch Ca(OH)2 vừa thu được đổ vào mẫu 2 kim loại còn lại, kim loại nào tan, sủi bọt khí là Al, kim loại không có hiện tượng gì là Mg
2Al + Ca(OH)2 + 2H2O → Ca(AlO2)2 + 3H2 ↑
Câu 3. Cho 5,4 gam Al vào dung dịch NaOH loãng, dư, sau phản ứng thu được V lít khí H2 (ở đktc)
A. 4,48 lít
B. 6,72 lít
C. 8,96 lít
D. 5,04 lít
Lời giải:
nAl = 0,2 mol
2Al + 2H2O + 2NaOH → 2NaAlO2 + 3H2
0,2 mol →0,3 mol
=> VH2 = 0,3 .22,4 = 6,72 lít
Câu 4. Quặng boxit là nguyên liệu chính dùng để điều chế kim loại
A. Al
B. Fe
C. Cu
D. Zn
Lời giải:
Câu 5. Các đồ vật làm bằng nhôm bền trong không khí và nước là do:
A. Có một lớp Al(OH)3 bên ngoài bảo vệ
B. Có một lớp Al2O3 bên ngoài bảo vệ
C. Nhôm không tan trong nước
D. Nhôm bền, không bị oxi hóa
Lời giải:
Đáp án: B
Đồ vật làm bằng nhôm bền trong không khí và nước là do có màng oxit Al2O3 bền vững bảo vệ.
Câu 6. Có 3 kim loại là Al, Fe và Na. Chỉ cần dùng thuốc thử nào sau đây có thể nhận ra từng kim loại?
A. Dung dịch H2SO4 đặc, nguội
B. Dung dịch Ca(OH)2
C. Nước
D. Dung dịch CuCl2
Lời giải:
Cho từng kim loại hòa tan vào nước
Kim loại không tan là Al và Fe
Na tan có khí thoát ra
Na + H2O → NaOH + H2
Dùng dung dịch NaOH nhận biết 2 kim loại Al và Fe
Kim loại nào tan dần là Al
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
Không có hiện tượng gì là Fe
Câu 7. Cho 2,7 gam Al vào dung dịch NaOH loãng, dư, sau phản ứng thu được V lít khí H2 (ở đktc)
A. 4,48 lít
B. 6,72 lít
C. 8,96 lít
D. 3,36 lít
Lời giải:
nAl= 0,1 mol
Phương trình phản ứng hóa học
2Al + 2H2O + 2NaOH → 2NaAlO2+ 3H2
0,1 mol →0,15 mol
=> VH2 = 0,15 .22,4 = 3,36 lít
Câu 8. Nhôm và nhôm hidroxit phản ứng được với cả hai dung dịch nào sau dây?
A. Na2SO4, KOH.
B. NaOH, HCl.
C. KCl, NaNO3.
D. NaCl, H2SO4.
Lời giải:
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
2Al + 6HCl → 2AlCl3 + 3H2
Al(OH)3+ NaOH → NaAlO2 + 2H2O
Al(OH)3+ 3HCl → AlCl3 + 3H2O.
Câu 9. Không được dùng nồi nhôm để nấu xà phòng vì
A. phản ứng không xảy ra
B. nhôm là kim loại có tính khử mạnh
C. chất béo phản ứng được với nhôm
D. nhôm sẽ bị phá hủy trong dung dịch kiềm
Lời giải:
Phương trình phản ứng:
Ban đầu lớp nhôm oxit bị phá hủy:
Al2O3 + 2NaOH → 2NaAlO2 + H2O
Sau đó nhôm tác dụng với nước, tạo ra nhôm hidroxit và bị phá hủy trong môi trường kiềm:
2Al + 2H2O + 2NaOH → 2NaAlO2 + 3H2↑
Câu 10. Phản ứng hóa học xảy ra trong trường hợp nào dưới đây không thuộc loại phản ứng nhiệt nhôm
A. Al tác dụng với H2SO4 đặc, nóng.
B. Al tác dụng với CuO nung nóng.
C. Al tác dụng với Fe2O3 nung nóng.
D. Al tác dụng với Fe3O4 nung nóng.
Lời giải:
Phản ứng nhiệt nhôm là phản ứng dùng nhôm để khử các oxit kim loại yếu hơn, phản ứng nhiệt nhôm thuộc loại phản ứng oxi hóa khử trong đó nhôm là chất khử.
Al tác dụng với H2SO4 đặc, nóng không phải là phản ứng nhiệt nhôm.
Câu 11. Trong số các phản ứng cho sau đây có mấy phản ứng viết sai:
1) 2Al + 3ZnSO4 → Al2(SO4)3 + 3Zn.
2) Al + 6HNO3 đặc, nguội→ Al(NO3)3 + 3NO2 + 3H2O.
3) 8Al + 5NaOH + 3NaNO3 + 2H2O → 8NaAlO2+ 3NH3
4) 2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
5) 2Al + 2H2O + Ca(OH)2 → Ca(AlO2)2 + 3H2
A. 1
B. 2
C. 3
D. 5
Lời giải:
Câu 12. Tính chất nào sau đây của nhôm là đúng?
A. Nhôm tác dụng với các axit ở tất cả mọi điều kiện
B. Nhôm tan được trong dung dịch NH3
C. Nhôm bị thụ động hóa với HNO3 đặc nguội và H2SO4 đặc nguội
D. Nhôm là kim loại lưỡng tính
Lời giải:
Đáp án: C
Câu 13. Oxi hóa hoàn toàn m gam bột Al trong khí O2 lấy dư, thu được 20,4 gam Al2O3. Giá trị của m là
A. 10,8.
B. 5,4.
C. 9,6.
D. 7,2.
Lời giải:
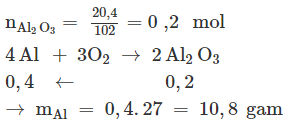
Câu 14. Để đốt cháy hoàn toàn a gam Al cần dùng hết 19,2 gam oxi. Phản ứng kết thúc thu được sản phẩm là Al2O3. Giá trị của a là
A. 21,6
B. 16,2
C. 18,0
D. 27,0
Lời giải:
nO2=19,232=0,6molnO2=19,232=0,6mol
PTHH: 4Al + 3O2 to→to→ 2Al2O3
Tỉ lệ theo PT: 4mol 3mol
?mol 0,6mol
=> số mol Al phản ứng là: nAl=0,6.43nAl=0,6.43 =0,8mol=0,8mol
=> khối lượng Al phản ứng là: mAl = 0,8.27 = 21,6 gam
Đáp án cần chọn là: A
Xem thêm các phương trình hóa học hay khác:
Al + NaOH + H2O → NaAlO2 + H2 | Al ra NaAlO2
Al + HCl → AlCl3 + H2 | Al ra AlCl3 | HCl ra H2
Al + H2SO4 (đặc,nóng) → Al2(SO4)3 + SO2 ↑ + H2O | Al + H2SO4 ra SO2




