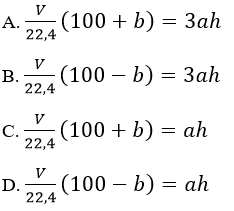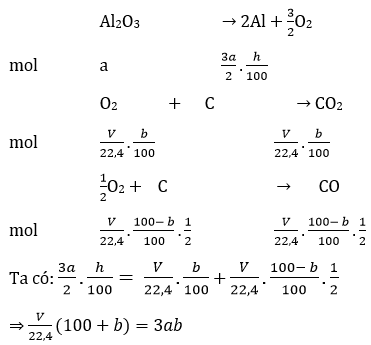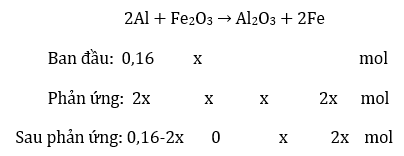Phản ứng Al + Fe2O3 → Al2O3 + Fe
1. Phương trình phản ứng Al ra Al2O3
2Al + Fe2O3 Al2O3 + 2Fe
2. Điều kiện phương trình phản ứng Al và Fe2O3 xảy ra
Nhiệt độ: 2000oC, có Mg làm mồi
3. Phản ứng nhiệt nhôm
Phản ứng nhiệt nhôm được định nghĩa là phản ứng hóa học tỏa nhiệt trong đó nhôm là chất khử ở trong nhiệt độ cao.
Phương trình tổng quát:
Al + oxit kim loại oxit nhôm + kim loại
(Hỗn hợp X) (Hỗn hợp Y)
4. Phản ứng nhiệt nhôm thường gặp
Ví dụ nổi bật nhất là phản ứng giữa oxit sắt III (Fe2O3) và nhôm (Al):
2Al + Fe2O3 2Fe + Al2O3
Một số phản ứng khác như:
8Al + 3Mn3O4 4Al2O3 + 9Mn
Cr2O3 + 2Al Al2O3 + 2Cr
5. Bài tập vận dụng
Câu 1. Khử hoàn toàn 16 gam bột Fe2O3 bằng bột nhôm. Hãy cho biết khối lượng bột nhôm cần dùng?
A. 2,7 gam.
B. 8,1 gam.
C. 5,4 gam.
D.10,2 gam.
Lời giải:
Đáp án: C
Fe2O3 + 2Al 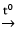
nFe2O3=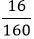
mAl=0,2.27=5,4 gam
Câu 2. Hỗn hợp X gồm Fe2O3 và Al có tỉ lệ mol tương ứng là 1:3. Thực hiện phản ứng nhiệt nhôm X (không có không khí) đến khi phản ứng xảy ra hoàn toàn thu được hỗn hợp gồm
A. Al2O3 và Fe
B. Al, Fe và Al2O3
C. Al, Fe, Fe2O3 và Al2O3
D. Al2O3, Fe và Fe2O3
Lời giải:
Đáp án: D
Fe2O3 + 2Al 
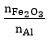
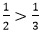
⇒ Sau phản ứng hỗn hợp là: Al2O3, Fe và Fe2O3 dư.
Câu 3. Trộn 8,1 (g) bột Al với 48g bột Fe2O3 rồi tiến hành phản ứng nhiệt nhôm trong điều kiện không có không khí, kết thúc thí nghiệm lượng chất rắn thu được là:
A. 61,5 g
B. 56,1 g
C. 65,1g
D. 51,6 g
Lời giải:
Đáp án: B
Áp dụng định luật bảo toàn khối lượng ta có:
mchất rắn=mAl+mFe2O3=8,1+48=56,1 gam
Câu 4. Điện phân a mol Al2O3 nóng cháy với điện cực bằng than chi. Hiệu suất điện phản là h%. Sau điện, tại anot thoát ra V lit khí (đktc) gồm khí ( O2 và CO, trong đó phần trăm CO2 là b% về thể tích. Biểu thức liên hệ giữa a b, V và h là:
Lời giải:
Đáp án: A
Câu 5. Cho m gam hỗn hợp X gồm 2 kim loại kiềm thuộc 2 chu kì liên tiếp tác dụng với 180 ml dung dịch Al2(SO4)3 1M thu được 15,6 gam kết tủa; khí H2 và dung dịch A. Nếu cho m gam hỗn hợp X tác dụng với 240 gam dung dịch HCI 18,25% thu được dung dịch B và H2. Cô cạn dung dịch B thu được 83,704 gam chất rắn khan. Biết rằng m < 45 gam. Phần trăm khối lượng của kim loại kiềm có nguyên tử khối nhỏ hơn trong X là:
A. 48,57%.
B. 37,10%.
C. 16,43%.
D. 28,22%.
Lời giải:
Đáp án: D
Đặt công thức chung của 2 kim loại là X : nAl3+ = 0,36 mol; nAl(OH)3 = 0,2 mol
Trường hợp 1: OH- phản ứng với AlAl3+ dư:
nOH- = 3n↓ = 0,6 = nX
trường hợp 2: OH- dư phản ứng AlAl3+
nOH- = 3nAlAl3+ + (nAlAl3+ - n↓) = 1,24 = nX
Nếu nX = 0,6 < nHCl ⇒ 83,704 gam muối XCl
⇒ nCl- = 0,6 mol hay mCl- = 21,3 gam ⇒ mX = 62,404 gam > 45(loại)
Nếu nX = 1,24 mol > nHCl ⇒ 83,704 gam gồm muối XCl( 1,2 mol) và XOH ( 0,04 mol)
⇒ mX = 40,424 < 45 . Ta có: X = 32,6
Hai kim loại kiềm là Na và K
Tính được số mol Na và K lần lượt là 0,496 và 0,744
%mNa = 28,22%
Câu 6. Hỗn hợp bột X gồm Al và Fe2O3. Nếu cho m gam hỗn hợp X tác dụng hết với dung dịch NaOH loãng thu được 5,376 lít H2 (đktc). Nếu nung nóng m gam hỗn hợp X để thực hiện hoàn toàn phản ứng nhiệt nhôm, thu được chắt rắn y. Cho Y phản ứng vừa du với V mi dung dịch hỗn hợp HCl 1M và H2SO4 0,5M tạo 4,4352 lít H2 (đklc) Giá trị cua V là :
A, 300 ml.
B. 450 ml.
C. 360 ml.
D. 600 ml.
Lời giải:
Đáp án: B
X phản ứng với NaOH được 5,376 lít H2 (đktc) ⇒ nAl = 0,16 mol
Phản ứng nhiệt nhôm:
Al và Fe phản ứng với hỗn hợp axit tạo khí ⇒ x = 0,042 mol
Từ các phản ứng của Al, Fe2O3, Al2O3, Fe với H+ trong V ml dung dịch hốn hợp HCl 1M và H2SO4 0,5M, tính được V = 450ml
Xem thêm các phương trình hóa học khác:
Al + HNO3 → Al(NO3)3 + NO + H2O | Al ra Al(NO3)3
Al + H2SO4 → Al2(SO4)3 + SO2 + H2O | Al ra Al2(SO4)3