Phương trình Ag2S + O2 to→ 2Ag↓ + SO2↑
1. Phương trình phản ứng hóa học
Ag2S + O2 to→ 2Ag↓ + SO2↑
2. Hiện tượng nhận biết phản ứng
Có khí mùi hắc thoát ra
3. Điều kiện phản ứng
Nhiệt độ: 500 – 600oC
4. Tính chất hoá học
4.1. Tính chất hoá học Ag2S
Phản ứng khử
Ag2S có thể được khử thành bạc kim loại bằng cách tắm các mảnh màu đen bằng nước nóng, NaOH, nhôm và muối. Phản ứng sau đây diễn ra:
Ag2S (s) + 2Al (s) + 3H2O (l) → 6Ag (s) + 3H2S (ac) + Al2O3(s)
+ Nhiệt phân Ag2S ở nhiệt độ cao
Ag2S → 2Ag + S
+ Nghiền nhỏ quặng bạc sunfua Ag2S, xử lí bằng dung dịch natri xianua, rồi lọc để thu được dung dịch muối phức bạc. Phản ứng tương tự cũng sảy ra với KCN.
Ag2S + 4NaCN → Na2S + 2Na[Ag(CN)2]
Trường hợp có H2O tham gia phản ứng
H2O + Ag2S + 4NaCN → NaOH + NaSH + 2Na[Ag(CN)2]
Đốt bạc sunfua sản phẩm tạo thành là bạc và khí SO2
O2 + Ag2S → 2Ag + SO2
4.2. Tính chất hoá học của O2
Khi tham gia phản ứng, nguyên tử O dễ dàng nhận thêm 2e. Nguyên tử oxi có độ âm điện lớn (3,44), chỉ kém flo (3,98).
Do vậy, oxi là nguyên tố phi kim hoạt động hoá học, có tính oxi hoá mạnh. Trong các hợp chất (trừ hợp chất với flo), nguyên tố oxi có số oxi hoá là -2.
Oxi tác dụng với hầu hết các kim loại (trừ Au, Pt, ...) và các phi kim (trừ halogen). Oxi tác dụng với nhiều hợp chất vô cơ và hữu cơ.
Tác dụng với kim loại
Tác dụng với hầu hết kim loại (trừ au và Pt), cần có to tạo oxit:
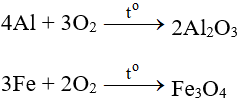
Tác dụng với phi kim
Tác dụng với hầu hết phi kim (trừ halogen), cần có to tạo oxit:
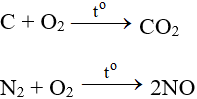 ĐB: Tác dụng với H2 nổ mạnh theo tỉ lệ 2:1 về số mol:
ĐB: Tác dụng với H2 nổ mạnh theo tỉ lệ 2:1 về số mol: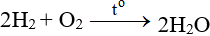
Tác dụng với hợp chất
- Tác dụng với các chất có tính khử:
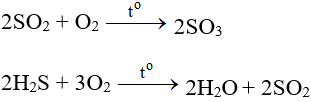 - Tác dụng với các chất hữu cơ:
- Tác dụng với các chất hữu cơ: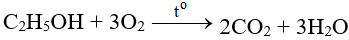
5. Cách thực hiện phản ứng
Đốt cháy Ag2S trong khí oxi dư
6. Bạn có biết
Bạc sunfua (Ag2S) là chất rắn màu đen dày đặc, được hình thành theo thời gian trên đồ bạc và các vật bạc khác, bạc sunfua không hòa tan trong tất cả các dung môi, nhưng bị phân hủy bởi axit mạnh.
7. Bài tập liên quan
Câu 1: Cho 21,6 g Ag tác dụng với dung dịch axit sunfuric đặc nóng thu được V lít khí SO2 điều kiện tiêu chuẩn. Giá trị của V là:
A. 2,24 lít
B. 4,48 lít
C. 1,12 lít
D. 5,6 lít
Hướng dẫn giải:
Đáp án: A
Ta có: nAg = 21,6/108 = 0,2 mol
2Ag + 2H2SO4 → Ag2SO4 + SO2 + 2H2O
Theo phương trình: nSO2 = 1/2.nAg = 1/2. 0,2 = 0,1 mol → VSO2(đktc) = 0,1.22,4 = 2,24 l
Câu 2: Cho phương trình hóa học sau:
2Ag + 2H2SO4 → Ag2SO4 + SO2 + 2H2O
Tổng hệ số tối giản của phương trình trên:
A. 6
B. 7
C. 8
D. 9
Hướng dẫn giải:
Đáp án: C
Phương trình phản ứng: 2Ag + 2H2SO4 → Ag2SO4 + SO2 + 2H2O
Câu 3. Cho a gam Ag tác dụng hoàn toàn với dung dịch H2SO4 đặc dư thu được 4,48 lit khí SO2 (đktc). Giá trị a là
A. 47,2 gam
B. 43,2 gam
C. 46,8 gam
D. 46,6 gam
Hướng dẫn giải:
Phương trình hóa học
2Ag + 2H2SO4 → Ag2SO4 + SO2 + 2H2O
nSO2 = 0,2 mol
Theo phương trình phản ứng ta có
nAg = 2.nSO2 = 0,1 mol => mAg = 0,4.108 = 43,2 gam
Câu 4. Có 6 dung dịch riêng biệt sau: NaCl, NaBr, KI, HCl, H2SO4, KOH. Để phân biệt các dung dịch trên, ta có thể dùng lần lượt các hợp chất nào sau đây?
A. quì tím, khí clo, dung dịch HNO3
B. dung dịch AgNO3, khí clo, hồ tinh bột
C. quì tím, AgNO3, dung dịch BaCl2
D. phenolphtalein, dung dịch Pb(NO3)2
Hướng dẫn giải:
Câu 5. Nhận xét nào sau đây không đúng về H2SO4?
A. H2SO4 tan tốt trong nước
B. Ở điều kiện thường H2SO4 là chất rắn.
C. H2SO4 có tính axit mạnh.
D. H2SO4 đặc có tính háo nước.
Hướng dẫn giải:




