Bài tập về Saccarozơ, tinh bột và xenlulozơ
Kiến thức cần nhớ
Saccarozơ (C12H22O11)
- Saccarozơ là loại đường phổ biến nhất, có trong nhiều loài thực vật, có nhiều nhất trong cây mía, củ cải đường và hoa thốt nốt.

Một số loại thực vật chứa nhiều saccarozơ
- Tùy theo nguồn gốc thực vật, các thương phẩm từ saccarozơ có tên là đường mía, đường củ cải, …
1. Tính chất vật lí
- Saccarozơ là chất rắn kết tinh, không màu, không mùi, có vị ngọt, nóng chảy ở 185oC.
- Saccarozơ tan tốt trong nước, độ tan tăng nhanh theo nhiệt độ (ở 20oC, 100ml nước hòa tan 211,5 gam saccarozơ; ở 90oC, 100ml nước hòa tan 420 gam saccarozơ).

Đường saccarozơ
2. Cấu tạo phân tử
- Saccarozơ không có phản ứng tráng bạc và không làm mất màu nước brom, chứng tỏ phân tử không có nhóm CHO.
- Khi đun nóng dung dịch saccarozơ với H2SO4 loãng được dung dịch có phản ứng tráng bạc do trong dung dịch thu được sau khi đun có glucozơ và fructozơ.
⇒ Saccarozơ là một đisaccarit được cấu tạo từ một gốc glucozơ và một gốc fructozơ liên kết với nhau qua nguyên tử oxi.
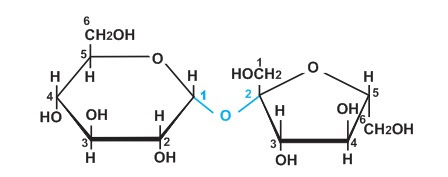
3. Tính chất hóa học
Vì không có nhóm chức anđehit (-CH=O) nên saccarozơ không có tính khử như glucozơ nhưng có tính chất của ancol đa chức. Mặt khác, do được cấu tạo từ 2 gốc monosaccarit nên saccarozơ có phản ứng thủy phân.
a. Phản ứng với Cu(OH)2
Dung dịch saccarozơ hòa tan kết tủa Cu(OH)2 thành dung dịch phức đồng saccarat màu xanh lam:
2 C12H22O11 + Cu(OH)2 → (C12H21O11)2Cu + 2H2O
b. Phản ứng thủy phân
Saccarozơ bị thủy phân thành glucozơ và fructozơ khi:
+ Đun nóng với dung dịch axit vô cơ.
+ Có xúc tác enzim trong hệ tiêu hóa của người.
C12H22O11 + H2O H+,to→ C6H12O6 (glucozơ) + C6H12O6 (fructozơ)
4. Sản xuất và ứng dụng
a. Sản xuất
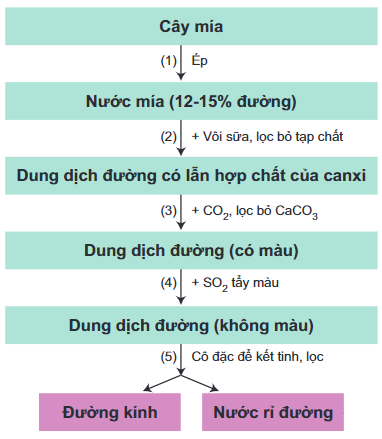
Saccarozơ được sản xuất từ cây mía, củ cải đường hoặc hoa thốt nốt. Ở nước ta, quy trình sản xuất saccarozơ từ cây mía gồm các công đoạn chính sau:
b. Ứng dụng
- Saccarozơ là thực phẩm quan trọng của con người.
- Trong công nghiệp thực phẩm saccarozơ là nguyên liệu để sản xuất bánh kẹo, nước giải khát...
- Trong công nghiệp dược phẩm để pha chế thuốc.
- Ngoài ra, saccarozơ còn là nguyên liệu để thủy phân thành glucozơ và frutozơ dùng trong kĩ thuật tráng gương, tráng ruột phích.
Tinh bột
1. Tính chất vật lý
- Tinh bột là chất rắn, ở dạng bột vô định hình, màu trắng, không tan trong nước lạnh.
- Trong nước nóng, hạt tinh bột sẽ ngậm nước và trương phồng lên tạo thành dung dịch keo gọi là hồ tinh bột.
- Tinh bột có nhiều trong các loại ngũ cốc, củ (khoai, sắn …), quả (táo, chuối xanh)…

Lương thực, thực phẩm giàu tinh bột
2. Cấu trúc phân tử
Tinh bột thuộc loại polisaccarit, phân tử gồm nhiều mắt xích α – glucozơ liên kết với nhau và có công thức là (C6H10O5)n. Các mắt xích α – glucozơ liên kết với nhau thành hai dạng: amilozơ và aminopectin.
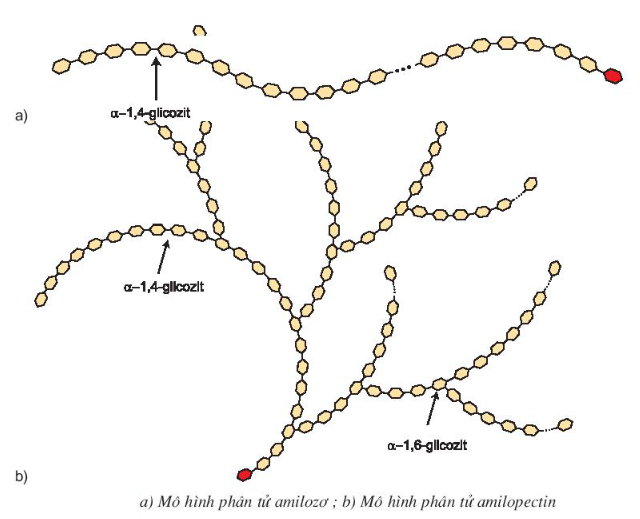
- Phân tử amilozơ
+ Các gốc α – glucozơ liên kết với nhau bằng liên kết α – 1,4 – glicozit tạo thành mạch dài, không phân nhánh và xoắn lại.
+ Amilozơ có phân tử khối lớn, vào khoảng 200 000.
- Phân tử amilopectin
+ Có cấu trúc mạch phân nhánh, do các đoạn α – glucozơ tạo nên.
+ Mỗi đoạn gồm 20 đến 30 mắt xích liên kết với nhau bằng liên kết α – 1,4 – glicozit.
+ Các đoạn mạch liên kết với nhau bằng liên kết α – 1,6 – glicozit.
+ Amilopectin có phân tử khối rất lớn khoảng 1 000 000 – 2 000 000, chính vì vậy amilopectin không tan trong nước cũng như các dung môi thông thường.
- Tinh bột được tạo thành trong cây xanh nhờ quá trình quang hợp:
6nCO2 + 5nH2O as→ (C6H10O5)n + 6nO2
3. Tính chất hóa học
a. Phản ứng thủy phân
- Đun nóng tinh bột trong dung dịch axit vô cơ loãng sẽ thu được glucozơ:
(C6H10O5)n + nH2O H+,to→ nC6H12O6
- Trong cơ thể người và động vật, tinh bột bị thủy phân thành glucozơ thành các enzim.
b. Phản ứng màu với iot
- Do cấu tạo mạch ở dạng xoắn, có lỗ rỗng, tinh bột hấp phụ iot cho màu xanh tím.

Tác dụng của hồ tinh bột với iot
- Đun nóng thì thấy mất màu, để nguội thì màu xanh tím lại xuất hiện.
4. Ứng dụng
- Tinh bột là một trong những dinh dưỡng cơ bản của con người và một số động vật.
- Trong công nghiệp tinh bột được dùng để sản xuất bánh kẹo, glucozơ và hồ dán.
- Trong cơ thể người, tinh bột bị thủy phân thành glucozơ nhờ các enzim trong nước bọt và ruột non. Phần lớn glucozơ được hấp thụ trực tiếp qua thành ruột vào máu đi nuôi cơ thể; phần còn dư lại được chuyển về gan. Ở gan, glucozơ được tổng hợp lại nhờ enzim thành glicogen dự trữ cho cơ thể.
Xenlulozơ
1. Tính chất vật lí, trạng thái tự nhiên
- Xenlulozơ là chất rắn dạng sợi, màu trắng, không mùi, không vị, không tan trong nước và trong dung môi hữu cơ thông thường như benzen, ete … nhưng tan trong nước svayde (dung dịch thu được khi hòa tan Cu(OH)2 trong NH3).
- Xenlulozơ là thành phần chính tạo ra lớp màng tế bào thực vật, bộ khung của cây cối.
- Xenlulozơ có nhiều trong bông nõn (95 – 98%), đay, gai, tre, nứa (50 – 80 %), gỗ (40 – 50 %)…

Xenlulozơ có nhiều trong bông nõn
2. Cấu trúc phân tử
- Xenlulozơ là polisaccarit, phân tử gồm nhiều gốc β – glucozơ liên kết với nhau thành mạch kéo dài, có phân tử khối rất lớn, vào khoảng 2 000 000. Nhiều mạch xenlulozơ ghép lại với nhau thành sợi xenlulozơ.
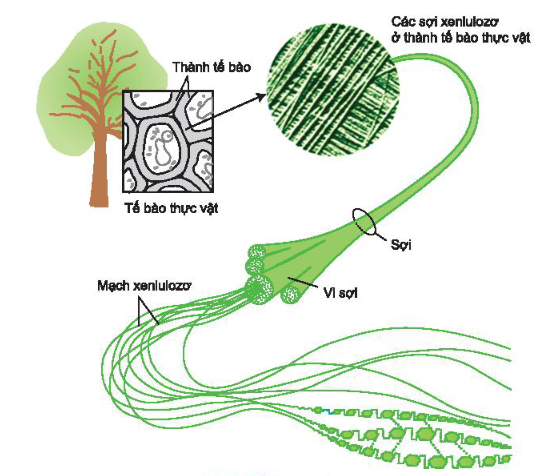
Sợi xenlulozơ
- Khác với tinh bột, xenlulozơ chỉ có cấu tạo mạch không phân nhánh mỗi gốc C6H10O5 ó 3 nhóm OH, nên có thể viết (C6H10O5)n hay [C6H7O2(OH)3]n.
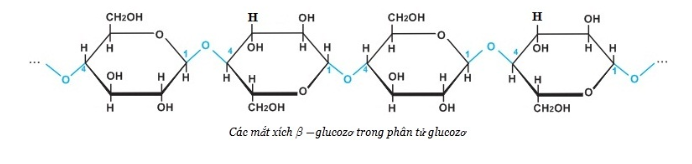
3. Tính chất hóa học
a. Phản ứng thủy phân
- Đun nóng xenlulozơ với dung dịch axit vô cơ đặc sẽ thu được glucozơ:
(C6H10O5)n + nH2O H+,to→ nC6H12O6
- Phản ứng thủy phân xenlulozơ cũng xảy ra nhờ enzim xenlulaza (trong dạ dày trâu, bò…). Cơ thể con người không đồng hóa được xenlulozơ.
b. Phản ứng với axit nitric
- Đun nóng xenlulozơ trong hỗn hợp axit nitric đặc và axit sunfuric đặc thu được xenlulozơ trinitrat:
[C6H7O2(OH)3]n + 3nHNO3 đặc H2SO4, to→ [C6H7O2(ONO2)3]n + 3nH2O
- Xenlulozơ trinitrat rất dễ cháy và nổ mạnh không sinh ra khói nên được dùng làm thuốc súng không khói.
4. Ứng dụng
- Những nguyên liệu chứa xenlulozơ (bông, đay, gỗ …) thường được dùng trực tiếp (kéo sợi dệt vải, trong xây dựng, làm đồ gỗ …) hoặc chế biến thành giấy.
- Xenlulozơ còn là nguyên liệu để sản xuất tơ nhân tạo như tơ visco, tơ axetat, chế tạo thuốc súng không khói và chế tạo phim ảnh.
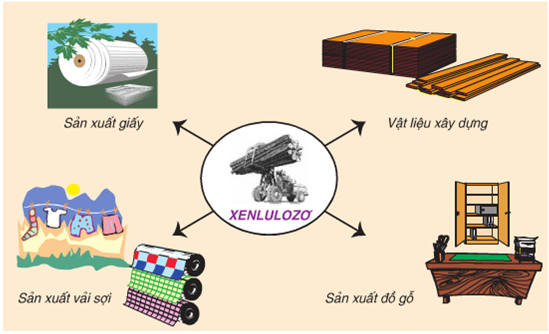
Một số ứng dụng của xenlulozơ
Các dạng bài tập về Saccarozơ, tinh bột và xenlulozơ
Dạng 1: Lý thuyết về disaccarit.
Dạng 2: Bài toán về thủy phân disaccarit
Dạng 3: Lý thuyết về polisaccarit
Dạng 4: Bài toán thủy phân, lên men tinh bột, xenlulozo
Dạng 5: Bài toán về phản ứng của xenlulozo với HNO3 (H2SO4 đặc, t0) và (CH3CO)2O
Phương pháp giải
- Xenlulozo có khả năng phản ứng với HNO3, (CH3CO)2O theo tỉ lệ 1:1, 1:2, 1:3 (do xenlulozo có chứa 3 nhóm –OH)
Bài tập tự luyện
1. Bài tập vận dụng
Câu 1: Giữa saccarozơ và glucozơ có đặc điểm giống nhau là :
A. Đều được lấy từ củ cải đường.
B. Đều có trong “huyết thanh ngọt”.
C. Đều bị oxi hoá bởi ion phức bạc amoniac [Ag(NH3)2]+.
D. Đều hoà tan Cu(OH)2 ở nhiệt độ thường cho dung dịch màu xanh lam.
Hướng dẫn giải chi tiết:
Saccarozo, glucozo đều có chức poli ancol (có từ 2 nhóm –OH đứng liền kề trong mạch chính C)
=> D đúng
A. Đều được lấy từ củ cải đường. (sai, glucozo có nồng độ không đáng kể trong củ cải đường)
B. Đều có trong “huyết thanh ngọt”. (sai, saccarozo không có trong huyết thanh ngọt)
C. Đều bị oxi hoá bởi ion phức bạc amoniac [Ag(NH3)2]+. (sai, saccarozo không có chức andehit –CHO nên không có phản ứng tráng bạc)
Đáp án D
Câu 2: Saccarozơ và mantozơ đều là đisaccarit vì
A. Có phân tử khối bằng 2 lần glucozơ.
B. Phân tử có số nguyên tử cacbon gấp 2 lần glucozơ.
C. Thủy phân sinh ra 2 đơn vị monosaccarit.
D. Có tính chất hóa học tương tự monosaccarit.
Hướng dẫn giải chi tiết:
Saccarozơ và mantozơ đều là đisaccarit vì thủy phân sinh ra 2 đơn vị monosaccarit.
Đáp án C
Câu 3: Thủy phân hoàn toàn 3,42 gam hỗn hợp X gồm saccarozơ và mantozơ thu được hỗn hợp Y. Biết rằng hỗn hợp Y phản ứng vừa đủ 0,015 mol Br2. Tính khối lượng mỗi loại đường có trong hỗn hợp.
Hướng dẫn giải chi tiết:
Gọi số mol của saccarozo, mantozo có trong hỗn hợp X lần lượt là x, y (mol)
Ta có phương trình phản ứng:
C12H22O11 + H2O H+,to→ C6H12O6 + C6H12O6 (1)
saccarozơ glucozơ fructozơ
mol: x → x → x
C12H22O11 + H2O H+,to→ 2C6H12O6 (2)
matozơ glucozơ
mol: y → 2y
CH2OH[CHOH]4CHO + Br2 + H2O → CH2OH[CHOH]4COOH + 2HBr (3)
mol: x+2y → x+2y
Theo (1), (2), (3) ta có :
{x+y=3,42342=0,01x+2y=0,015⇒{x=0,005y=0,005
=> m Saccarozo = 0,05 * 342 = 17,1 gam
m Mantozo = 0,05 * 342 = 17,1 gam.
Câu 4: Thuỷ phân 62,5 gam dung dịch saccarozơ 17,1% trong môi trường axit (vừa đủ) được dung dịch X. Cho dung dịch AgNO3/NH3 vào X và đun nhẹ được m gam Ag (biết các phản ứng xảy ra hoàn toàn). Giá trị của m là
A. 13,5.
B. 7,5.
C. 6,75.
D. 10,8.
Hướng dẫn giải chi tiết:
Khối lượng saccarozo có trong dung dịch là:
62,5 . 17,1 : 100 = 10,6875 gam
n Saccarozo = 10,6875 : 342 = 0,03125 (mol)
Ta có phương trình:
C12H22O11 + H2O H+,to→ C6H12O6 + C6H12O6 (1)
saccarozơ glucozơ fructozơ
=> n Glucozo = n Fructozo = 0,03125 (mol)
n Ag = 2 . n Glucozo + 2 . n Fructozo = 2 x (0,03125 + 0,03125) = 0,125 mol
=> m Ag = 0,125 x 108 = 13,5 gam
Đáp án A
Câu 5: Cho 50 gam hỗn hợp X gồm glucozơ và saccarozơ vào nước thu dược dung dịch Y. Dung dịch Y này làm mất màu vừa đủ 160 gam dung dịch brom 20%. % khối lượng của saccarozơ trong hỗn hợp X là:
A. 40%
B. 28%
C. 72%
D. 25%
Hướng dẫn giải chi tiết:
m Br2 = 160 * 20 : 100 = 32 (gam)
n Br2 = 32 : 160 = 0,2 mol
Ta có phương trình:
CH2OH[CHOH]4CHO + Br2 + H2O → CH2OH[CHOH]4COOH + 2HBr (1)
(1) => n Glucozo = nBr2 = 0,2 mol
=> m Glucozo = 0,2 * 180 = 36 gam
=> m Saccarozo = 50 – 36 = 14 gam
% m Saccarozo = 14 : 50 * 100% = 28%
Đáp án B
Câu 6: Tính chất của tinh bột là : Polisaccarit (1), không tan trong nước (2), có vị ngọt (3), thuỷ phân tạo thành glucozơ (4), thuỷ phân tạo thành fructozơ (5), làm cho iot chuyển thành màu xanh (6), dùng làm nguyên liệu để điều chế đextrin (7). Những tính chất sai là :
A. (2), (5), (6), (7).
B. (2), (5), (7).
C. (3), (5).
D. (2), (3), (4), (6).
Hướng dẫn giải chi tiết:
(3) sai, tinh bột là chất không có vị
(5) sai, tinh bột thủy phân tạo thành glucozo
Đáp án C.
Câu 7: Trong phân tử xenlulozơ các mắt xích liên kết với nhau bằng liên kết nào ?
A. α-1,4-glicozit.
B. α-1,4-glucozit.
C. β-1,4-glicozit.
D. β-1,4-glucozit.
Hướng dẫn giải chi tiết:
Trong phân tử xenlulozo, các mắt xích liên kết với nhau bằng liên kết β-1,4-glicozit.
Đáp án C
Câu 8: Chọn những câu đúng trong các câu sau :
(1) Xenlulozơ không phản ứng với Cu(OH)2 nhưng tan được trong dung dịch [Cu(NH3)4](OH)2.
(2) Glucozơ được gọi là đường mía.
(3) Dẫn khí H2 vào dung dịch glucozơ, đun nóng, xúc tác Ni thu được poliancol.
(4) Glucozơ được điều chế bằng cách thủy phân tinh bột nhờ xúc tác HCl hoặc enzim.
(5) Dung dịch saccarozơ không có phản ứng tráng Ag, không bị oxi hóa bởi nước brom, chứng tỏ phân tử saccarozơ không có nhóm –CHO.
(6) Mantozơ thuộc loại đisaccarit có tính oxi hóa và tính khử.
(7) Tinh bột là hỗn hợp của 2 polisaccarit là amilozơ và amilopectin.
A. 1, 2, 5, 6, 7.
B. 1, 3, 4, 5, 6, 7.
C. 1, 3, 5, 6, 7.
D. 1, 2, 3, 6, 7.
Hướng dẫn giải chi tiết:
(2) sai do glucoxo được gọi là đường nho
Đáp án B.
Câu 9: Tinh bột và xenlulozơ khác nhau về
A. Sản phẩm của phản ứng thuỷ phân.
B. Khả năng phản ứng với Cu(OH)2.
C. Thành phần phân tử.
D. Cấu trúc mạch cacbon.
Hướng dẫn giải chi tiết:
- Tinh bột được liên kết từ các phân tử glucozo bởi liên kết α-1,4-glicozit và α-1,6-glicozit.
- Xenlulozo được liên kết từ các phân tử glucozo bởi liên kết β-1,4-glicozit.
=> Khác nhau về cấu trúc mạch cacbon.
Đáp án D.
Câu 10: Khi thuỷ phân 1 kg bột gạo có 80% tinh bột, thì khối lượng glucozơ thu được là bao nhiêu? Giả thiết rằng phản ứng xảy ra hoàn toàn.
A. 0,80 kg.
B. 0,90 kg.
C. 0,99 kg.
D. 0,89 kg.
Hướng dẫn giải chi tiết:
Khối lượng tinh bột có trong 1kg bột gạo là:
1000 . 80 : 100 = 800 (gam)
=> n C6H10O5 = 800 : 162 = 400/81 (mol)
Ta có phương trình phản ứng:
C6H10O5 + H2O C6H12O6 (1)
(1) => n C6H12O6 = n C6H10O5 = 400/81 (mol)
=> m C6H12O6 = 400/81 * 180 = 888,89 gam = 0,89 kg
Đáp án D
Câu 11: Đi từ 150 gam tinh bột sẽ điều chế được bao nhiêu ml ancol etylic 46o bằng phương pháp lên men ancol? Cho biết hiệu suất phản ứng đạt 81% và d = 0,8 g/ml.
A. 46,875 ml.
B. 93,75 ml.
C. 21,5625 ml.
D. 187,5 ml.
Hướng dẫn giải chi tiết:
n C6H10O5 = 150 : 162 = 25/27 (mol)
Ta có phương trình phản ứng:
C6H10O5 + H2O xt,t0→ C6H10O6 (1)
C6H10O6 xt,t0→ 2 C2H5OH + 2 CO2 (2)
(1) n C6H10O6 = n C6H10O5 = 25/27 mol
(2) n C2H5OH = 2 n C6H10O6 = 50/27 mol
Mặt khác, hiệu suất của phản ứng là 81%
=> n C2H5OH thực tế thu được là:
50/27 * 81% = 1,5 mol
m C2H5OH tinh khiết là:
1,5 . 46 = 69 (gam)
V C2H5OH tinh khiết là:
69 : 0,8 = 86,25 (ml)
=> V C2H5OH 46o là : 86,25 : 46 . 100 = 187,5 ml
Đáp án D
Câu 12: Xenlulozơ trinitrat được điều chế từ phản ứng giữa axit nictric với xenlulozơ (hiệu suất phản ứng 60% tính theo xenlulozơ). Nếu dùng 2 tấn xenlulozơ thì khối lượng xenlulozơ trinitrat điều chế được là :
A. 2,97 tấn.
B. 3,67 tấn.
C. 2,20 tấn.
D. 1,10 tấn.
Hướng dẫn giải chi tiết:
Ta có phương trình phản ứng:
C6H7O2(OH)3 + 3HNO3 → C6H7O2(ONO2)3+3H2O (1)
Từ phương trình ta nhận thấy:
1 mol C6H7O2(OH)3↔ 1 mol C6H7O2(ONO2)3
=> 162 gam C6H7O2(OH)3↔ 297 gam C6H7O2(ONO2)3
=> 2 tấn C6H7O2(OH)3↔ x tấn C6H7O2(ONO2)3
=> x = 2 . 297 : 162 = 11/3 tấn
Mặt khác, hiệu suất của phản ứng là 60%
=> Khối lượng của xenlutrinitrat thu được sau quá trình điều chế là:
11/3 * 60% = 2,2 tấn.
Đáp án C
Câu 13: Xenlulozơ trinitrat là chất dễ cháy và nổ mạnh, được điều chế từ xenlulozơ và axit nitric. Muốn điều chế 29,7 kg xenlulozơ trinitrat (hiệu suất 90%) thì thể tích axit nitric 96% (d = 1,52 g/ml) cần dùng là
A. 14,16 lít.
B. 15 lít.
C. 1,416 lít.
D. 24,39 lít.
Hướng dẫn giải chi tiết:
Ta có phương trình phản ứng:
C6H7O2(OH)3 + 3HNO3 → C6H7O2(ONO2)3 + 3H2O (1)
Từ phương trình hóa học ta nhận thấy:
3 mol HNO3 tạo ra được 1 mol C6H7O2(ONO2)3
=> 186 gam HNO3 tạo ra được 297 gam C6H7O2(ONO2)3
=> x gam HNO3 tạo ra 29,7 kg C6H7O2(ONO2)3
=> x = 18,6 kg
Mặt khác, hiệu suất của quá trình bằng 90%
=> Thực tế khối lượng HNO3 tinh khiết cần dùng là:
18,6 : 90 . 100% = 62/3 (kg)
=> Khối lượng dung dịch HNO3 96% đã dùng là:
62/3 : 96 . 100 = 21,53 (kg)
=> Thể tích dung dịch HNO3 96% đã dùng là:
21,53 : 1,52 = 14,16 lít
Đáp án A
2. Bài tập tự luyện có hướng dẫn
(Xem thêm ở file bên dưới)
Xem thêm các câu hỏi và bài tập liên quan khác
70 Bài tập về Kim loại kiềm thổ (có đáp án)
70 Bài tập về Kim loại kiềm và hợp chất quan trọng của kim loại kiềm (có đáp án)
70 Bài tập về Điều chế kim loại (2024) có đáp án chi tiết nhất
70 Bài tập hợp kim (có đáp án)
70 Bài tập Tính chất của kim loại. Dãy điện hóa của kim loại (2024) có đáp án chi tiết nhất











