Bài tập về Kim loại kiềm và hợp chất quan trọng của kim loại kiềm
Kiến thức cần nhớ

Sơ đồ tư duy: Kim loại kiềm và hợp chất quan trọng của kim loại kiềm
KIM LOẠI KIỀM
I. VỊ TRÍ VÀ CẤU TẠO NGUYÊN TỬ
Kim loại kiềm là những kim loại thuộc nhóm IA, đứng đầu các chu kì (trừ chu kì I) gồm có các nguyên tố
Liti Natri Kali Rubidi Xesi Franxi
=> Đây là những nguyên tố s, có 1e lớp ngoài cùng (ns1) nên những nguyên tử này dễ dàng nhường đi 1e để có được cấu hình bền khi tham gia phản ứng hóa học.
=> Kim loại kiềm có tính khử mạnh.
II. TÍNH CHẤT VẬT LÍ
- Liên kết kim loại yếu
- Là những kim loại rất nhẹ và mềm, dẫn điện và dẫn nhiệt tốt.
- Nhiệt độ nóng chảy và nhiệt độ sôi thấp, giảm từ Li đến Fr.
- Độ cứng nhỏ
III. TÍNH CHẤT HÓA HỌC
- Các kim loại kiềm có tính khử mạnh: M → M+ + 1e.
- Trong mọi hợp chất, kim loại kiềm có số oxi hóa +1.
1. Tác dụng với phi kim
4Na + O2 → 2Na2O
K + Cl2 → 2KCl
2. Tác dụng với axit (HCl, H2SO4 loãng) để sinh ra muối mới + khí H2
2M + 2H+ → 2M+ + H2
2Na + 2HCl → 2NaCl + H2↑
Na dư + H2O → NaOH + 1/2 H2↑
3. Tác dụng với nước
Kim loại kiềm dễ dàng tác dụng với nước để sinh ra dung dịch kiềm tương ứng + khí H2
2M + H2O → 2MOH + H2
Na + H2O → NaOH + 1/2 H2↑
4. Tác dụng với dung dịch muối
- Khi cho Na tác dụng với dd muối CuSO4 sẽ có bọt khí và kết tủa Cu(OH)2 màu xanh.
2Na + 2H2O → 2NaOH + H2↑
2NaOH + CuSO4 → Na2SO4 + Cu(OH)2↓
Chú ý: Khi cho kim loại kiềm vào dung dịch muối, đầu tiên kim loại kiềm sẽ tác dụng với nước sau đó bazo sinh ra có thể tác dụng với muối.
IV. ỨNG DỤNG VÀ ĐIỀU CHẾ
1. Ứng dụng
- Chế tạo hợp kim có nhiệt độ nóng chảy thấp dùng trong thiết bị báo cháy,...
- Các kim loại kali và natri dùng làm chất trao đổi nhiệt trong một vài loại lò phản ứng hạt nhân.
- Kim loại xesi dùng chế tạo tế bào quang điện.
- Kim loại kiềm được dùng để điều chế một số kim loại hiếm bằng phương pháp nhiệt luyện.
- Kim loại kiềm được dùng làm chất xúc tác trong nhiều phản ứng hữu cơ.
2. Điều chế
Điện phân nóng chảy muối của kim loại kiềm.
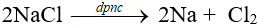
MỘT SỐ HỢP CHẤT QUAN TRỌNG CỦA KIM LOẠI KIỀM
I. NATRI HIDROXIT (NaOH)
1.Tính chất vật lí
Là chất rắn, không màu dễ hút ẩm, dễ nóng chảy, tan nhiều trong nước
2. Tính chất hóa học
Mang đầy đủ tính chất của bazo điển hình (tác dụng với axit, oxit axit, một số dung dịch muối)
3. Điều chế
Điện phân dung dịch NaCl (có màng ngăn)
2NaCl + 2H2O H2 + Cl2 + 2NaOH
II. NATRI HIDROCACBONAT (NaHCO3)
1. Tính chất vật lí
Là chất rắn, ít tan trong nước
2. Tính chất hóa học
- Bị phân hủy bởi nhiệt:
2NaHCO3 Na2CO3 + H2O + CO2
- NaHCO3 tác dụng với cả dung dịch axit và dung dịch bazo
NaHCO3 + HCl → NaCl + H2O + CO2
NaHCO3 + NaOH → Na2CO3 + H2O
=> NaHCO3 có tính lưỡng tính.
3. Ứng dụng
Natri hiđrocacbonat được dùng trong y học (làm thuốc chữa đau dạ dày) , công nghệ thực phẩm, chế tạo nước giải khát,...
III. NATRI CACBONNAT (Na2CO3)
1. Tính chất vật lí
Dễ tan trong nước, nóng chảy ở 850oC.
2. Tính chất hóa học
Là muối có khả năng tác dụng với dung dịch axit, một số dung dịch muối:
Na2CO3 + 2HCl → 2NaCl + H2O + CO2
Na2CO3 + CaCl2 → 2NaCl + CaCO3
3. Ứng dụng
- Là nguyên liệu trong công nghiệp sản xuất thủy tinh, xà phòng, giấy, ....
- Dùng trong công nghiệp sản xuất chất tẩy rửa, ...
Các dạng bài tập Kim loại kiềm và hợp chất quan trọng của kim loại kiềm
Dạng 1: Lí thuyết trọng tâm
Dạng 2: Bài toán xác định kim loại
Dạng 3: Bài toán liên quan đến dung dịch kiềm
Bài toán 1: Dung dịch kiềm tác dụng với axit
Bài toán 2: Bài toán CO2 tác dụng với dung dịch kiềm
Bài toán 3: Cho P2O5 hoặc H3PO4 tác dụng với dung dịch kiềm
Dạng 4: Muối cacbonat và muối hiđrocacbonat tác dụng với axit
Bài tập tự luyện
1. Bài tập vận dụng
Câu 1: Câu nào sau đây mô tả đúng sự biến đổi tính chất của các kim loại kiềm theo chiều điện tính hạt nhân tăng dần ?
A. Bán kính nguyên tử giảm dần.
B. Nhiệt độ nóng chảy tăng dần.
C. Năng lượng ion hoá I1 của nguyên tử giảm dần.
D. Khối lượng riêng của đơn chất giảm dần.
Hướng dẫn giải chi tiết:
A. Bán kính nguyên tử giảm dần. (sai, theo chiều tăng điện tích hạt nhân, bán kính nguyên tử tăng dần)
B. Nhiệt độ nóng chảy tăng dần. (sai, theo chiều tăng điện tích hạt nhân, nhiệt độ nóng chảy giảm dần)
C. Năng lượng ion hoá I1 của nguyên tử giảm dần. (đúng)
D. Khối lượng riêng của đơn chất giảm dần. (sai)
Đáp án C.
Câu 2: Để điều chế kim loại Na, người ta thực hiện phản ứng
A. điện phân dung dịch NaOH.
B. điện phân nóng chảy NaCl hoặc NaOH.
C. cho dung dịch NaOH tác dụng với dung dịch HCl.
D. cho dung dịch NaOH tác dụng với H2O.
Hướng dẫn giải chi tiết:
Để điều chế kim lại Na người ta thường điện phân nóng chảy NaCl hoặc NaOH
Đáp án B
Câu 3: Kim loại kiềm có nhiều ứng dụng quan trọng : (1) Chế tạo các hợp kim có nhiệt độ nóng chảy thấp ; (2) Kim loại Na và K dùng làm chất trao đổi nhiệt trong các lò phản ứng hạt nhân ; (3) Kim loại xesi dùng làm tế bào quang điện ; (4) Các kim loại Na, K dùng để điều chế các dung dịch bazơ ; (5) kim loại kiềm dùng để điều chế các kim loại hiếm bằng phương pháp nhiệt luyện. Phát biểu đúng là :
A. 1, 2, 3, 5.
B. 1, 2, 3, 4.
C. 1, 3, 4, 5.
D. 1, 2, 4, 5.
Hướng dẫn giải chi tiết:
Các ứng dụng quan trọng của kim loại kiềm là:
(1) Chế tạo các hợp kim có nhiệt độ nóng chảy thấp.
(2) Kim loại Na và K dùng làm chất trao đổi nhiệt trong các lò phản ứng hạt nhân.
(3) Kim loại xesi dùng làm tế bào quang điện.
(5) kim loại kiềm dùng để điều chế các kim loại hiếm bằng phương pháp nhiệt luyện.
Đáp án A
Câu 4: Cho 4,017 gam một kim loại kiềm M hòa tan vào nước dư được dung dịch Y. Trung hòa dung dịch Y cần vừa đủ 0,103 mol HCl. Kim loại X là :
A. Na.
B. Li.
C. Rb.
D. K.
Hướng dẫn giải chi tiết:
Ta có phương trình phản ứng:
2M + 2H2O → 2MOH + H2 (1)
mol: 0,103 0,103
MOH + HCl → MCl + H2O (2)
mol: 0,103 0,103
n M = n MOH = n HCl = 0,103 mol
=> M = 4,017 : 0,103 = 39
=> M là K
Đáp án D
Câu 5: Hỗn hợp X gồm hai kim loại A, B nằm kế tiếp nhau trong cùng nhóm IA. Lấy 6,2 gam X hoà tan hoàn toàn vào nước thu được 2,24 lít hiđro (đktc). A, B là :
A. Li, Na.
B. Na, K.
C. K, Rb.
D. Rb, Cs.
Hướng dẫn giải chi tiết:
Gọi kí hiệu hóa học chung của 2 kim loại A, B là R
Ta có phương trình phản ứng :
2R + 2H2O → 2ROH + H2
mol: 0,2 0,1
(g/mol).
Vậy 2 kim loại là Na (23) và K (39).
Đáp án B
Câu 6: Hoà tan hoàn toàn 8,5 gam hỗn hợp X gồm Na và K vào nước, thu được dung dịch Y và V lít khí H2 (đktc). Trung hoà Y bằng H2SO4, sau đó cô cạn dung dịch, thu được 22,9 gam muối. Giá trị của V là :
A. 6,72.
B. 4,48.
C. 3,36.
D. 2,24.
Hướng dẫn giải chi tiết:
Ta có sơ đồ phản ứng:
Áp dụng định luật bảo toàn khối lượng
m SO4 có trong dung dịch là: 22,9 – 8,5 = 14,4 gam
=> n SO4 = 14,4 : 96 = 0,15 mol
Áp dụng định luật bảo toàn điện tích trong dung dịch muối:
n Na+ + n K+ = 2. n SO42-
=> n Na+ + n K+ = 2 . 0,15 = 0,3 (mol)
Ta có phương trình tổng quát như sau
R + H2O → ROH + ½ H2
=> n H2 = ½ n R = 0,15 mol
=> V H2 = 0,15 . 22,4 = 3,36 lít
Câu 7: Dẫn từ từ 5,6 lít CO2 (đktc) vào 400 ml dung dịch chứa đồng thời các chất NaOH 0,3M; KOH 0,2M; Na2CO3 0,1875M; K2CO3 0,125M thu được dung dịch X. Thêm dung dịch CaCl2 dư vào dung dịch X, số gam kết tủa thu được là:
Hướng dẫn giải chi tiết:
nCO2 = 0,25 mol; nNaOH = 0,12 mol; nKOH = 0,08 mol; nNa2CO3 = 0,075 mol; nK2CO3 = 0,05 mol
=> nCO3 = 0,125 mol ; nOH = 0,2 mol
Vì nOH- < nCO2 => CO2 phản ứng với OH- tạo HCO3-
CO2 + OH- → HCO3-
0,2 ← 0,2
CO2 + CO32- + H2O → 2HCO3-
0,05 → 0,05
=> nCO3 = 0,125 – 0,05 = 0,075 mol
=> nCaCO3 = nCO3 = 0,075 => mCaCO3 = 7,5g
Câu 8: Sục từ từ V lít khí CO2 (đktc) từ từ vào 500 ml dung dịch hỗn hợp NaOH 0,6M; KOH 0,2M và Ba(OH)2 0,4M. Kết thúc phản ứng thu được 27,58 gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Giá trị lớn nhất của V thỏa mãn điều kiện của bài toán là
Hướng dẫn giải chi tiết:
V lớn nhất khi có hiện tượng hòa tan kết tủa
nOH = nNaOH + nKOH + 2nBa(OH)2 = 0,8 mol
nBaCO3 = 0,14 mol < nBa2+ = 0,2 mol => CO32- tạo hết thành kết tủa
=> nCO2 = nOH – nBaCO3 = 0,66 mol
=> V = 14,784 lít.
2. Bài tập tự luyện có hướng dẫn
(Xem thêm trong file dưới đây)
Xem thêm các dạng câu hỏi và bài tập liên quan khác:
Tính chất hóa học của rượu Etylic (ancol etylic hoặc etanol) chi tiết nhất (2024)
1000 Bài tập hóa 12 Chương 6: Kim loại kiềm. kim loại kiềm thổ. nhôm (có đáp án)
1000 Bài tập hóa 12 Chương 5: Đại cương về kim loại (có đáp án)
1000 Bài tập hóa 12 Chương 4: Polime và vật liệu polime (2024) có đáp án chi tiết nhất












