Bài tập về Sơ lược về bảng tuần hoàn các nguyên tố hóa học
Lý thuyết
1. Nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn
Các nguyên tố trong bảng tuần hoàn được sắp xếp theo chiều tăng dần của điện tích hạt nhân nguyên tử.
2. Cấu tạo bảng tuần hoàn
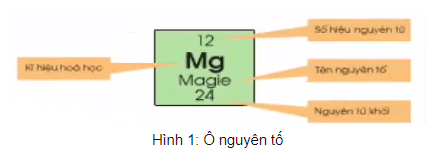
a. Ô nguyên tố
- Ô nguyên tố cho biết: Số hiệu nguyên tử, kí hiệu hóa học, tên nguyên tố, nguyên tử khối của nguyên tố đó.
- Số hiệu nguyên tử có số trị bằng số đơn vị điện tích hạt nhân và bằng số electron trong nguyên tử. Số hiệu nguyên tử trùng với số thứ tự ô trong bảng tuần hoàn.
Ví dụ:
Số hiệu nguyên tử của nhôm là 13 cho biết: nhôm ở ô thứ 13 trong bảng tuần hoàn, điện tích hạt nhân nguyên tử nhôm là 13+ (hay số đơn vị điện tích hạt nhân là 13), có 13 electron trong nguyên tử nhôm.
b. Chu kì
- Chu kỳ là dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron và được xếp theo chiều điện tích hạt nhân tăng dần.
- Số thứ tự chu kì bằng số lớp electron.
- Bảng tuần hoàn gồm có 7 chu kỳ: chu kỳ 1, 2, 3 là các chu kỳ nhỏ. Chu kỳ 4, 5, 6, 7 là các chu kỳ lớn. Ví dụ
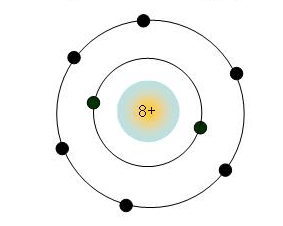
+) Chu kì 2: Gồm 8 nguyên tố từ Li đến Ne, có 2 lớp electron trong nguyên tử. Điện tích hạt nhân tăng dần từ Li là 3+,… đến Ne là 10+.
+) Mô phỏng cấu tạo nguyên tử O ở chu kỳ 2, có 2 lớp electron.
c. Nhóm
- Nhóm gồm các nguyên tố mà nguyên tử của chúng có số electron lớp ngoài cùng bằng nhau, do đó có tính chất tương tự nhau được xếp thành một cột theo chiều tăng của điện tích hạt nhân nguyên tử.
- Số thứ tự của các nhóm A bằng số electron ở lớp ngoài cùng của nguyên tử trong nhóm đó.
Ví dụ:
+) Nhóm IA: Gồm các nguyên tố kim loại hoạt động mạnh. Nguyên tử của chúng đều có 1 electron ở lớp ngoài cùng. Điện tích hạt nhân tăng từ Li (3+), … đến Fr (87+).
+) Mô phỏng cấu tạo nguyên tử Kali ở nhóm IA, có 1 electron ở lớp ngoài cùng:
3. Sự biến đổi tính chất của các nguyên tố trong bảng tuần hoàn
a. Trong một chu kì
Trong một chu kỳ, khi đi từ đầu đến cuối chu kỳ theo chiều tăng của điện tích hạt nhân:
- Số e lớp ngoài cùng của nguyên tử tăng dần từ 1 đến 8 electron.
- Tính kim loại của các nguyên tố giảm dần, đồng thời tính phi kim của các nguyên tố tăng dần.
Ví dụ:
Chu kì 2 gồm 8 nguyên tố:
+ Số e lớp ngoài cùng của nguyên tử các nguyên tố trong chu kỳ 2 tăng dần từ 1 đến 8
+ Đẩu chu kỳ 2 là một kim loại mạnh (Li), cuối chu kỳ là một phi kim mạnh (F), kết thúc chu kỳ là một khí hiếm (Ne).
b. Trong một nhóm
Trong một nhóm, khi đi từ trên xuống dưới theo chiều tăng của điện tích hạt nhân.
- Số lớp electron của nguyên tử tăng dần.
- Tính kim loại của các nguyên tố tăng dần, đồng thời tính phi kim của các nguyên tố giảm dần.
Ví dụ:
Nhóm IA gồm 6 nguyên tố từ Li đến Fr
+) Số lớp electron tăng dần từ 2 đến 7. Số electron lớp ngoài cùng của nguyên tử đều bằng 1.
+) Tính kim loại của các nguyên tố tăng dần. Đầu nhóm IA, Li là kim loại hoạt động hóa học mạnh cuối nhóm là kim loại Fr hoạt động hóa học rất mạnh
4. Ý nghĩa của bảng tuần hoàn nguyên tố hóa học
a. Biết vị trí của nguyên tố ta có thể suy đoán cấu tạo nguyên tử và tính chất của nguyên tố.
Ví dụ:
Biết: Nguyên tố A có số hiệu nguyên tử là 17, chu kì 3, nhóm VIIA.
Xác định được:
+) Nguyên tố A có số hiệu nguyên tử là 17, suy ra điện tích hạt nhân của nguyên tử A là 17+, nguyên tử A có 17 electron.
+) A ở chu kì 3, suy ra nguyên tử A có 3 lớp electron. Vì ở gần cuối chu kì 3 nên A là một phi kim mạnh, tính phi kim của A mạnh hơn của nguyên tố trước nó trong cùng chu kì (là S có số hiệu là 16).
+) A ở nhóm VIIA nên lớp ngoài cùng có 7 electron, tính phi kim của A yếu hơn của nguyên tố phía trên nó trong cùng nhóm (là F có số hiệu nguyên tử là 9) nhưng mạnh hơn nguyên tố đứng dưới nó trong cùng nhóm (là Br có số hiệu nguyên tử là 35).
b. Biết cấu tạo nguyên tử của nguyên tố có thể suy đoán vị trí và tính chất nguyên tố đó.
Ví dụ:
Biết: Nguyên tố X có điện tích hạt nhân là 11+, nguyên tử X có 3 lớp electron, lớp ngoài cùng có 1 electron.
Xác định được:
+ Nguyên tử X có điện tích hạt nhân là 11+ suy ra X ở ô 11
+ Nguyên tử X có 3 lớp electron nên X ở chu kỳ 3
+ Nguyên tử X có 1e ở lớp ngoài cùng nên X ở nhóm IA.
- Nguyên tố X là kim loại vì ở đầu chu kì
Bài tập tự luyện
Bài 1: Bảng tuần hoàn các nguyên tố hóa học được sắp xếp theo nguyên tắc :
A. Chiều nguyên tử khối tăng dần.
B. Chiều điện tích hạt nhân tăng dần.
C. Tính kim loại tăng dần.
D. Tính phi kim tăng dần.
Lời giải
Bảng tuần hoàn các nguyên tố hóa học được sắp xếp theo chiều điện tích hạt nhân tăng dần.
Đáp án: B
Bài 2: Số thứ tự chu kì trong bảng hệ thống tuần hoàn cho biết
A. Số thứ tự của nguyên tố.
B. Số electron lớp ngoài cùng.
C. Số hiệu nguyên tử
D. Số lớp electron.
Lời giải
Số thứ tự chu kì trong bảng hệ thống tuần hoàn cho biết số lớp electron.
Đáp án: D
Bài 3: Số thứ tự nhóm trong bảng hệ thống tuần hoàn cho biết:
A. Số electron lớp ngoài cùng.
B. Số thứ tự của nguyên tố.
C. Số hiệu nguyên tử.
D. Số lớp electron.
Lời giải
Số thứ tự nhóm trong bảng hệ thống tuần hoàn cho biết: Số electron lớp ngoài cùng
Đáp án: A
Bài 4: Dãy nào sau đây thể hiện mức độ hoạt động hóa học của kim loại tăng dần:
A. Be, Fe, Ca, Cu.
B. Ca, K, Mg, Al.
C. Al, Zn, Co, Ca.
D. Ni, Mg, Li, Cs.
Lời giải
Dãy thể hiện mức độ hoạt động hóa học của kim loại tăng dần là: Ni, Mg, Li, Cs.
Loại A vì Ca có tính kim loại mạnh hơn Cu.
Loại B vì Mg có tính kim loại mạnh hơn Al
Loại C vì Al có tính kim loại mạnh hơn Zn
Đáp án: D
Bài 5: Dãy các nguyên tố sắp xếp theo chiều tính phi kim tăng dần:
A. Mg, Na, Si, P.
B. Ca, P, B, C.
C. C, N, O, F.
D. O, N, C, B.
Lời giải
Dãy các nguyên tố sắp xếp theo chiều tính phi kim tăng dần: C, N, O, F vì 4 nguyên tố này cùng thuộc 1 chu kì và cùng sắp xếp theo chiều tăng điện tích hạt nhân.
Đáp án: C
Bài 6: Phát biểu nào sau đây là không đúng:
A. Bảng tuần hoàn gồm có các ô nguyên tố, các chu kì và các nhóm
B. Chu kì là dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron, sắp xếp theo Z tăng dần
C. Bảng tuần hoàn có 7 chu kì, số thứ tự của chu kì bằng số phân lớp electron trong nguyên tử
D. Bảng tuần hoàn có 8 nhóm A, 8 nhóm B, 18 cột trong đó nhóm A có 8 cột và nhóm B có 10 cột
Lời giải
Phát biểu không đúng là: Bảng tuần hoàn có 7 chu kì, số thứ tự của chu kì bằng số phân lớp electron trong nguyên tử.
Số thứ tự của chu kì bằng số lớp electron trong nguyên tử
Đáp án: C
Bài 7: Dãy công thức hoá học của oxit tương ứng với các nguyên tố hoá học thuộc chu kì 3 là:
A. Na2O, MgO, Al2O3, SiO2, P2O5, SO3, Cl2O7
B. Na2O, MgO, K2O, SiO2, P2O5, SO3, Cl2O7
C. Na2O, MgO, K2O, SO2, P2O5, SO3, Cl2O7
D. K2O, MgO, Al2O3, SiO2, P2O5, SO3, Cl2O7
Lời giải
Dãy công thức hoá học của oxit tương ứng với các nguyên tố hoá học thuộc chu kì 3 là: Na2O, MgO, Al2O3, SiO2, P2O5, SO3, Cl2O7
Đáp án: A
Bài 8: Nguyên tố X có cấu tạo như sau: điện tích hạt nhân là 11+, 3 lớp electron, lớp ngoài cùng có 1 electron. Tính chất hóa học cơ bản của X là
A. Tính kim loại mạnh.
B. Tính phi kim mạnh.
C. X là khí hiếm.
D. Tính kim loại yếu.
Lời giải
Từ vị trí này ta biết:
+ Nguyên tố X có số hiệu nguyên tử là 11, đó là Na.
+ Nguyên tố X ở chu kì 3, do đó có 3 lớp electron.
+ Nguyên tố X ở nhóm I có 1e lớp vỏ ngoài cùng, nguyên tố A ở đầu chu kì nên có tính kim loại mạnh.
Đáp án: A
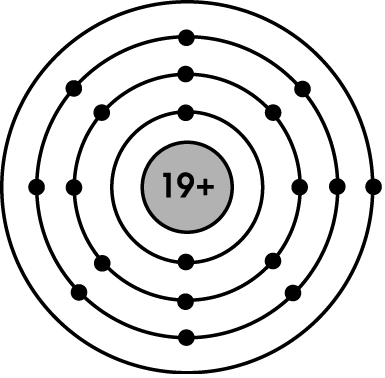
Bài 9: Nguyên tố B có điện tích hạt nhân bằng 19+, có 4 lớp electron, có 1e ở lớp ngoài cùng. Hãy cho biết vị trí của nguyên tố B?
A. B thuộc ô 18, chu kì 4, nhóm IB.
B. B thuộc ô 19, chu kì 3, nhóm II.
C. B thuộc ô 19, chu kì 4, nhóm I.
D. B thuộc ô 18, chu kì 3, nhóm I.
Lời giải
Ta có:
+ Nguyên tố B có điện tích hạt nhân là 19+ nên B thuộc ô thứ 19
+ Nguyên tố B có 4 lớp e nên B thuộc chu kì 4.
+ Nguyên tố B có 1 e lớp ngoài cùng nên B thuộc nhóm I
Đáp án: C
Bài 10: Biết nguyên tố X có số hiệu là 17, chu kì 3, nhóm VII. Hãy cho biết cấu tạo nguyên tử và tính chất của nguyên tố X?
A. X có 3 lớp e, lớp ngoài cùng có 7e, X là phi kim mạnh.
B. X có 4 lớp e, lớp ngoài cùng có 17e, X là phi kim mạnh.
C. X có 3 lớp e, lớp ngoài cùng có 7e, X là kim loại mạnh.
D. X có 4 lớp e, lớp ngoài cùng có 17e, X là kim loại mạnh.
Lời giải
- Nguyên tố X có số hiệu nguyên tử là 17 => đó là Cl
- Nguyên tố X có số hiệu nguyên tử là 17 => điện tích hạt nhân là 17+, có 17 proton, 17 electron
- Nguyên tố X ở chu kì 3 => có 3 lớp electron
- Nguyên tố X thuộc nhóm VII => lớp e ngoài cùng có 7e
Vì X ở cuối chu kì 3 nên X là phi kim mạnh
Đáp án: A
Bài 11: Các nguyên tố xếp ở chu kì 6 có số lớp electron trong nguyên tử:
A. 3 B. 5
C. 6 D. 7
Lời giải
Các nguyên tố xếp ở chu kì 6 có số lớp electron trong nguyên tử là 6
Đáp án: C
Bài 12: Trong bảng tuần hoàn các nguyên tố, số chu kì nhỏ và số chu kì lớn:
A. 3 và 3
B. 4 và 3
C. 4 và 4
D. 3 và 4
Lời giải
Trong bảng tuần hoàn các nguyên tố gồm 7 chu kì. Trong đó 3 chu kì nhỏ (chu kì 1, 2, 3) và 4 chu kì lớn (chu kì 4, 5, 6, 7).
Đáp án: D
Bài 13: Số nguyên tố trong chu kì 3 và 5 lần lượt là:
A. 8 và 18
B. 18 và 8
C. 8 và 8
D. 18 và 32
Lời giải
Chu kì 3 là chu kì nhỏ => có 8 nguyên tố
Chu kì 5 là chu kì lớn => có 18 nguyên tố
Đáp án: A
Bài 14: A là khí không màu mùi hắc, rất độc và nặng hơn không khí
Hãy xác định công thức của hợp chất khí A, biết rằng
+ A là oxit của lưu huỳnh chưa 50% oxi
+ 1 gam khí A chiến thể tích 0,35 lit ở đktc
A. SO
B. SO3
C. SO2
D. NO2
Lời giải
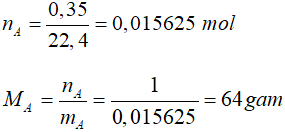
– Tìm số nguyên tử S, O trong phân tử A
![]()
mS = 64 – 32 = 32g => ns = 32/32 = 1 mol
Suy ra trong 1 phân tử A có 1S và 2O, công thức của A là SO2
Đáp án: C
Bài 15: Nhóm các nguyên tố được sắp xếp theo chiều tính phi kim tăng dần là
A. O, F, N, C.
B. F, O, N, C.
C. O, N, C, F.
D. C, N, O, F.
Đáp án: D
Các nguyên tố C, N, O, F cùng thuộc chu kỳ 2;
Trong một chu kỳ, theo chiều tăng của điện tích hạt nhân tính phi kim của các nguyên tố tăng dần
→ Tính phi kim: C < N < O < F.
Bài 16: Trong 1 chu kỳ (trừ chu kì 1), đi từ trái sang phải tính chất của các nguyên tố biến đổi như sau
A. tính kim loại và tính phi kim đều giảm dần.
B. tính kim loại và tính phi kim đều tăng dần.
C. tính kim loại giảm dần đồng thời tính phi kim tăng dần.
D. tính kim loại tăng dần đồng thời tính phi kim giảm dần.
Đáp án: C
Xem thêm các dạng bài tập hóa học hay, chi tiết khác:
30 Bài tập của Dãy hoạt động hóa học của kim loại (2024) có đáp án chi tiết nhất
30 Bài tập về Silic. Công nghiệp silicat (2024) có đáp án chi tiết nhất
30 Bài tập về Axit cacbonic và muối cacbonat (2024) có đáp án chi tiết nhất
30 Bài tập về Các oxit của cacbon (2024) có đáp án chi tiết nhất