Bài tập về nitơ
Kiến thức cần nhớ
Vị trí và cấu hình electron nguyên tử

- Nitơ (nitrogen) ở ô thứ 7, nhóm VA, chu kì 2 của bảng tuần hoàn.
- Cấu hình electron nguyên tử của nitơ là 1s22s22p3.
⇒ Ba electron ở phân lớp 2p có thể tạo được ba liên kết cộng hóa trị với các nguyên tử khác.
- Phân tử nitơ gồm hai nguyên tử, giữa chúng hình thành một liên kết ba: N ≡ N .
Tính chất vật lí
- Ở điều kiện thường, nitơ là chất khí không màu, không mùi, không vị, hơi nhẹ hơn không khí, hóa lỏng ở -196 oC.
- Khí nitơ tan rất ít trong nước.
- Nitơ không duy trì sự cháy và sự hô hấp.
Tính chất hóa học
- Liên kết ba trong phân tử nitơ rất bền.
⇒ Ở nhiệt độ thường, nitơ khá trơ về mặt hóa học.
- Ở nhiệt độ cao, nitơ có thể tác dụng được với nhiều chất.
- Khi tham gia phản ứng oxi hóa - khử, số oxi hóa của nitơ có thể giảm hoặc tăng, do đó nó thể hiện tính oxi hóa hoặc tính khử.
- Tính oxi hóa vẫn là tính chất chủ yếu của nitơ.
1. Tính oxi hóa
Trong phản ứng với kim loại và hiđro, số oxi hóa của nguyên tố nitơ giảm từ 0 đến -3, nitơ thể hiện tính oxi hóa
a. Tác dụng với kim loại
- Ở nhiệt độ cao, nitơ tác dụng được với một số kim loại hoạt động như Ca, Mg, Al,... tạo thành nitrua kim loại.
Thí dụ:
Chú ý: Li có thể phản ứng với N2 ở ngay nhiệt độ thường.
b. Tác dụng với hiđro
- Ở nhiệt độ cao, áp suất cao và có mặt chất xúc tác, nitơ tác dụng trực tiếp với hiđro, tạo ra khí amoniac.
2. Tính khử
Ở nhiệt độ khoảng 3000oC (hoặc nhiệt độ của lò hồ quang điện), nitơ kết hợp trực tiếp với oxi, tạo ra khí nitơ monooxit NO.
- Trong thiên nhiên, khí NO được tạo thành khi có sấm sét.

Hình 1: Sấm sét cung cấp năng lượng cho phản ứng giữa N2 và O2 tạo thành NO
- Ở điều kiện thường, khí NO không màu kết hợp ngay với oxi của không khí, tạo ra khí nitơ đioxit NO2 màu nâu đỏ.
Lưu ý: Các oxit khác của nitơ như N2O, N2O3, N2O5, chúng không điều chế được bằng tác dụng trực tiếp giữa nitơ và oxi.
Ứng dụng
- Nguyên tố nitơ là một trong những thành phần dinh dưỡng chính của thực vật.
- Trong công nghiệp, phần lớn lượng nitơ sản xuất ra được dùng để tổng hợp khí amoniac, từ đó sản xuất ra axit nitric, phân đạm, ...
- Nhiều ngành công nghiệp như luyện kim, thực phẩm, điện tử, ... sử dụng nitơ làm môi trường trơ. Nitơ lỏng được dùng để bảo quản máu và các mẫu vật sinh học khác.
Trạng thái tự nhiên
- Trong tự nhiên, nitơ tồn tại ở dạng tự do (khí N2 chiếm 78,16% thể tích của không khí) và dạng hợp chất.
- Nitơ thiên nhiên là hỗn hợp của hai đồng vị:
(99,63%); (0,37%).
- Ở dạng hợp chất, nitơ có nhiều trong khoáng chất natri nitrat NaNO3, với tên gọi là diêm tiêu natri.
Điều chế
1. Trong công nghiệp
- Nitơ được sản xuất bằng phương pháp chưng cất phân đoạn không khí lỏng.
+ Sau khi đã loại bỏ CO2 và hơi nước, không khí được hóa lỏng dưới áp suất cao và nhiệt độ rất thấp.
+ Nâng nhiệt độ không khí lỏng đến -196 oC thì nitơ sôi và được lấy ra, còn lại là oxi lỏng, vì oxi lỏng có nhiệt độ sôi cao hơn (-183 oC).
- Khí nitơ được vận chuyển trong các bình thép, nén dưới áp suất 150 atm.
2. Trong phòng thí nghiệm
- Một lượng nhỏ nitơ tinh khiết được điều chế bằng cách đun nóng nhẹ dung dịch bão hoà muối amoni nitrit:
NH4NO2N2↑ + H2O
- Tuy nhiên, muối này kém bền, có thể được thay thế bằng dung dịch bão hoà của amoni clorua và natri nitrit:
NH4Cl + NaNO2N2↑ + NaCl + 2H2O
Các dạng bài tập về nitơ
Dạng 1: Câu hỏi lí thuyết
Phương pháp giải
- Nito Là chất khí không màu, không mùi ít tan trong nước và không duy trì sự sống, sự cháy
- CTCT có chứa liên kết 3 nên khá trơ về mặt hóa học ở nhiệt độ thường
- Thể hiện tính OXH (khi tác dụng với KL mạnh và Hidro) và khử (khi tác dụng với O2)
Dạng 2: Bài tập tác dụng với
Phương pháp giải
Bước 1: Viết phương trình hóa học.
Bước 2: Tính toán theo yêu cầu của đề bài.
Công thức tính hiệu suất:
+ Theo chất tham gia:
+ Theo chất sản phẩm:
Dạng 3: Bài toán về phản ứng tổng hợp và phân hủy NH3
Phương pháp giải
Ta có phương trình phản ứng:
N2 (k) + 3H2 (k) 2NH3 (k)
Hằng số cân bằng của phản ứng thuận là:
Đề làm được loại bài toán này, em cần khảo sát phương trình phản ứng qua các giai đoạn: đề bài, phản ứng, sau phản ứng. Dựa vào đặc điểm dữ kiện đề bài cho để tìm ra đáp số cho bài toán.
Bài tập tự luyện
Bài : 1
Chiều tăng dần số oxi hoá của N trong các hợp chất của nitơ dưới đây là
Chọn một đáp án dưới đây
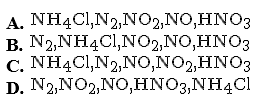
Đáp án là : (C)
Bài : 2
Trong nhóm N, khi đi từ N đến Bi, điều khẳng định nào dưới đây không đúng?
Chọn một đáp án dưới đây
A. Trong các axit, axit nitric là axit mạnh nhất
B. Khả năng oxi hoá giảm dần do độ âm điện giảm dần
C. Tính phi kim tăng dần, đồng thời tính kim loại giảm dần
D. Tính axit của các oxit giảm dần, đồng thời tính bazơ tăng dần
Đáp án là : (C)
Bài : 3
Trong nhóm N, khi đi từ N đến Bi, điều khẳng định nào dưới đây không đúng?
Chọn một đáp án dưới đây
A. Độ âm điện các nguyên tố giảm dần
B. Bán kính của nguyên tử các nguyên tố tăng dần
C. Năng lượng ion hoá của các nguyên tố giảm dần
D. Nguyên tử các nguyên tố đều có cùng số lớp electron
Đáp án là : (D)
Bài : 4
Cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố nhóm nitơ (VA) là cấu hình nào dưới đây?
Chọn một đáp án dưới đây
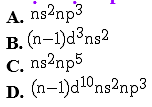
Đáp án là : (A)
Bài : 5
Nung 11,2 gam Fe và 26 gam Zn với một lượng S dư. Sản phẩm của phản ứng được hoà tan hoàn toàn trong dung dịch H2SO4 loãng, toàn bộ khí sinh ra được dẫn vào dung dịch CuSO4 10% (d = 1,2 gam/ml). Biết các phản ứng xảy ra hoàn toàn. Thể tích tối thiểu của dung dịch CuSO4 cần để hấp thụ hết khí sinh ra là
Chọn một đáp án dưới đây
A. 700 ml
B. 800 ml
C. 600 ml
D. 500 ml
Đáp án là : (B)
Bài : 6
Đốt cháy hoàn toàn 1,2 gam một muối sunfua của kim loại. Dẫn toàn bộ khí thu được sau phản ứng đi qua dung dịch nước Br2 dư, sau đó thêm tiếp dung dịch BaCl2 dư thì thu được 4,66 gam kết tủ
Chọn một đáp án dưới đây
A. Thành phần % về khối lượng của lưu huỳnh trong muối sunfua là bao nhiêu? A. 36,33%
B. 46,67%
C. 53,33%
D. 26,66%
Đáp án là : (C)
Bài : 7
Để phản ứng vừa đủ với 100ml dung dịch BaCl2 2M cần phải dùng 500ml dung dịch Na2SO4 với nồng độ bao nhiêu?
Chọn một đáp án dưới đây
A. 0,1 M
B. 0,4 M
C. 1,4 M
D. 0,2 M
Đáp án là : (B)
Bài : 8
Cho V lít SO2(đktc) tác dụng hết với dung dịch Br2 dư thu được dung dịch A. Cho dung dịch A tác dụng BaCl2 với dư thu được 2,33 gam kết tủa. Thể tích V là
Chọn một đáp án dưới đây
A. 0,112 lít
B. 1,12 lít
C. 0,224 lít
D. 2,24 lít
Đáp án là : (C)
Bài : 9
Để trung hoà 500 ml dung dịch X chứa hỗn hợp HClO 0,1M và H2SO4 0,3M cần bao nhiêu ml dung dịch hỗn hợp gồm [/ct]NaOH[/ct] 0,3M và Ba(OH)2 0,2M?
Chọn một đáp án dưới đây
A. 250ml
B. 500ml
C. 125ml
D. 750ml
Đáp án là : (B)
Bài 10
Sục từ từ 2,24 lít SO2 (đktc) vào 100 ml dung dịch NaOH 3M. Các chất có trong dung dịch sau phản ứng là
Chọn một đáp án dưới đây
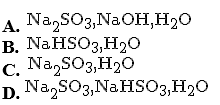
Đáp án là : (A)
Bài : 11
Cho hỗn hợp gồm Fe, FeS tác dụng với dung dịch HCl dư thu được 2,24 lít hỗn hợp khí ở điều kiện tiêu chuẩn. Hỗn hợp khí này có tỉ khối so với hiđro là 9. Thành phần % theo số mol của hỗn hợp Fe và FeS ban đầu lần lượt là
Chọn một đáp án dưới đây
A. 40% và 60%
B. 50% và 50%
C. 35% và 65%
D. 45% và 55%
Đáp án là : (B)
Bài : 12
Để thu được 6,72 lít O2(đktc), cần phải nhiệt phân hoàn toàn bao nhiêu gam tinh thể ![]() (khi có
(khi có ![]() xúc tác)?
xúc tác)?
Chọn một đáp án dưới đây
A. 21,25 gam
B. 42,50 gam
C. 63,75 gam
D. 85,00 gam
Đáp án là : (B)
Bài : 13
Xét cân bằng hoá học: ![]()
Tỉ lệ SO3 trong hỗn hợp lúc cân bằng sẽ lớn hơn khi
Chọn một đáp án dưới đây
A. tăng nhiệt độ và giảm áp suất
B. tăng nhiệt độ và áp suất không đổi
C. giảm nhiệt độ và tăng áp suất
D. cố định nhiệt độ và giảm áp suất
Đáp án là : (C)
Bài : 14
Cho phản ứng: ![]()
Cân bằng chuyển dịch sang phải nếu
Chọn một đáp án dưới đây
A. tăng nhiệt độ
B. thêm vào SO3
C. giảm áp suất
D. giảm nhiệt độ thích hợp và tăng áp suất
Đáp án là : (D
Bài :15
Để pha loãng dung dịch H2SO4 đậm đặc, trong phòng thí nghiệm, người ta tiến hành theo cách nào dưới đây?
Chọn một đáp án dưới đây
A. Cho từ từ nước vào axit và khuấy đều
B. Cho từ từ axit vào nước và khấy đều
C. Cho nhanh nước vào axit và khuấy đều
D. Cho nhanh axit vào nước và khuấy đều
Đáp án là : (B)
Bài : 16
Các khí sinh ra khi cho saccarozơ vào dung dịch H2SO4 đặc, nóng dư gồm:
Chọn một đáp án dưới đây
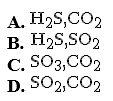
Đáp án là : (D)
Bài : 17
Cho khí H2S lội qua dung dịch CuSO4 thấy có kết tủa màu xám đen xuất hiện, chứng tỏ
Chọn một đáp án dưới đây
A. có phản ứng oxi hoá - khử xảy ra
B. có kết tủa CuS tạo thành, không tan trong axit mạnh
C. axit sunfuhiđric mạnh hơn axit sunfuric
D. axit sunfuric mạnh hơn axit sunfuhiđric
Đáp án là : (B)
Bài : 18
Oxit nào dưới đây không thể hiện tính khử trong tất cả các phản ứng hoá học?
Chọn một đáp án dưới đây
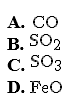
Đáp án là : (C)
Bài :19
Có hai ống nghiệm, một ống đựng dung dịch NaCl, một ống đựng dung dịch Na2SO3. Chỉ dùng một hoá chất trong số các chất sau: dung dịch HCl, dung dịch H2SO4, dung dịch BaCl2, dung dịch Ba(HCO3)2 thì số thuốc thử có thể dùng để phân biệt hai dung dịch trên là bao nhiêu?
Chọn một đáp án dưới đây
A. 1
B. 2
C. 3
D. 4
Đáp án là : (D)
Bài : 20
Chỉ dùng một thuốc thử nào dưới đây để phân biệt các lọ đựng riêng biệt khí SO2 và CO2?
Chọn một đáp án dưới đây
A. dung dịch brom trong nước
B. dung dịch NaOH
C. dung dịch BaSO4
D. dung dịch K(OH)2
Đáp án là : (A)
Xem thêm các dạng câu hỏi và bài tập liên quan khác:
30 bài tập về Andehit (2024) có đáp án chi tiết nhất
30 bài tập về Sulfuric acid và muối sulfate (2024) có đáp án chi tiết nhất
30 bài tập về Ammonia. Muối ammonium (2024) có đáp án chi tiết nhất
30 Bài tập về Khái niệm về cân bằng hoá học (2024) có đáp án chi tiết nhất
30 Bài tập về Nitrogen (2024) có đáp án chi tiết nhất










