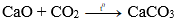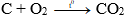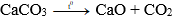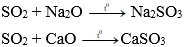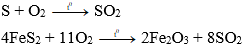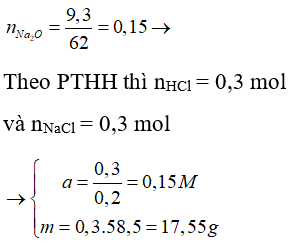Bài tập về Một số oxit quan trọng
Lý thuyết
CANXI OXIT
- Công thức hóa học là CaO, tên thông thường là vôi sống, là chất rắn, màu trắng.
1. Tính chất hóa học
CaO có đầy đủ tính chất hóa học của oxit bazơ.
a) Tác dụng với nước: CaO (r) + H2O (l) → Ca(OH)2 (r)
Phản ứng của CaO với nước gọi là phản ứng tôi vôi, phản ứng này tỏa nhiều nhiệt.
Chất Ca(OH)2 tạo thành gọi là vôi tôi, là chất rắn màu trắng, ít tan trong nước, phần tan tạo thành dung dịch bazơ còn gọi là nước vôi trong.
CaO có tính hút ẩm mạnh nên được dùng để làm khô nhiều chất.
b) Tác dụng với axit tạo thành muối và nước.
Ví dụ:
CaO + 2HCl → CaCl2 + H2O
Nhờ tính chất này, CaO được dùng để khử chua đất trồng trọt, xử lý nước thải của nhiều nhà máy hóa chất, …
c) Tác dụng với oxit axit tạo thành muối.
Ví dụ:
Vì vậy CaO sẽ giảm chất lượng nếu lưu giữ lâu ngày trong tự nhiên.
2. Ứng dụng của canxi oxit
CaO có những ứng dụng chủ yếu sau đây:
- Phần lớn canxi oxit được dùng trong công nghiệp luyện kim và làm nguyên liệu cho công nghiệp hóa học.
- Ngoài ra, canxi oxit còn được dùng để khử chua đất trồng trọt, xử lí nước thải công nghiệp, sát trùng, diệt nấm, khử độc môi trường,…
- Canxi oxit có tính hút ẩm mạnh nên được dùng để làm khô nhiều chất.
3. Sản xuất canxi oxit trong công nghiệp
Nguyên liệu để sản xuất canxi oxit là đá vôi (chứa CaCO3). Chất đốt là than đá, củi, dầu, khí tự nhiên,…
Các phản ứng hóa học xảy ra khi nung đá vôi:
- Than cháy sinh ra khí CO2 và tỏa nhiều nhiệt:
- Nhiệt sinh ra phân hủy đá vôi ở khoảng trên 900°C:
LƯU HUỲNH ĐIOXIT
- Công thức hóa học là SO2, tên gọi khác là khí sunfurơ.
1. Tính chất vật lí
Lưu huỳnh đioxit là chất khí không màu, mùi hắc, độc (gây ho, viêm đường hô hấp…), nặng hơn không khí.
2. Tính chất hóa học
Lưu huỳnh đioxit có đầy đủ tính chất hóa học của oxit axit.
a) Tác dụng với nước tạo thành dung dịch axit:
SO2 + H2O → H2SO3 (axit sunfurơ)
SO2 là chất gây ô nhiễm không khí, là một trong các nguyên nhân gây ra mưa axit.
b) Tác dụng với dung dịch bazơ tạo thành muối và nước:
Ví dụ:
SO2 + Ca(OH)2 → CaSO3 ↓ + H2O
Khi SO2 dư sẽ tiếp tục có phản ứng sau:
SO2 (dư) + H2O + CaSO3 ↓ → Ca(HSO3)2
Như vậy khi cho SO2 tác dụng với dung dịch bazơ tùy theo tỉ lệ về số mol mà sản phẩm thu được là muối trung hòa, muối axit hoặc hỗn hợp cả hai muối.
c) Tác dụng với oxit bazơ (tan) tạo thành muối:
Ví dụ:
3. Ứng dụng của lưu huỳnh đioxit
- Phần lớn SO2 dùng để sản xuất axit sunfuric (H2SO4).
- Ngoài ra, SO2 còn dùng để làm chất tẩy trắng bột gỗ trong công nghiệp giấy, dùng làm chất diệt nấm mốc,…
4. Điều chế lưu huỳnh đioxit
a) Trong phòng thí nghiệm: Cho muối sunfit tác dụng với axit mạnh như HCl, H2SO4.
Ví dụ:
Na2SO3 + H2SO4 → Na2SO4 + SO2 ↑ + H2O
Khí SO2 được thu bằng phương pháp đẩy không khí.
b) Trong công nghiệp: Đốt lưu huỳnh hoặc quặng pirit sắt (FeS2) trong không khí.
Ví dụ:
Bài tập tự luyện
Bài 1: Để nhận biết hai chất rắn màu trắng CaO và P2O5 ta dùng:
A. nước và quỳ tím
B. dung dịch NaCl
C. dung dịch KOH
D. quỳ tím khô
Lời giải
Để nhận biết hai chất rắn màu trắng CaO và P2O5 ta dùng: nước và quỳ tím
- Cho 2 chất rắn vào nước => 2 chất rắn tan hết, tạo thành dung dịch
CaO + H2O → Ca(OH)2
P2O5 + 3H2O → 2H3PO4
- Cho quỳ tím vào 2 dung dịch thu được
+ dung dịch làm quỳ chuyển xanh là Ca(OH)2 => chất rắn ban đầu là CaO
+ dung dịch làm quỳ chuyển đỏ là H3PO4 => chất rắn ban đầu là P2O5
Đáp án: A
Bài 2: BaO tác dụng được với các chất nào sau đây?
A. H2O, NO, KOH
B. NaOH, SO3, HCl
C. P2O5, CuO, CO
D. H2O, H2CO3, CO2
Lời giải
BaO tác dụng được với: H2O, H2CO3, CO2.
BaO + H2O → Ba(OH)2
BaO + H2CO3 → BaCO3 + H2O
BaO + CO2 → BaCO3
Loại A vì BaO không phản ứng với KOH
Loại B vì BaO không phản ứng với NaOH
Loại C vì BaO không phản ứng với CO.
Đáp án: D
Bài 3: Lưu huỳnh trioxit (SO3) tác dụng được với:
A. Nước, sản phẩm là bazơ
B. Axit, sản phẩm là bazơ
C. Nước, sản phẩm là axit
D. Bazơ, sản phẩm là axit
Lời giải
SO3 là oxit axit
=> tác dụng với nước cho sản phẩm là axit và tác dụng với bazo cho sản phẩm là muối
Đáp án: C
Bài 4: Một loại đá vôi chứa 80% CaCO3. Nung 1 tấn đá vôi loại này có thể thu được bao nhiêu kg vôi sống (CaO), nếu hiệu suất là 85%?
A. 308,8 kg
B. 388,8 kg
C. 380,8 kg
D. 448,0 kg
Lời giải
1 tấn đá vôi chứa 80% CaCO3 => mCaCO3 = 0,8 tấn = 800 kg
CaCO3 → CaO + CO2
100 kg 56 kg
800 kg → 448 kg
Vì hiệu suất là 85% => mCaOthực tế = 448.85% = 380,8 kg
Đáp án: C
Bài 5: Từ 10 kg đá vôi ( không lẫn tạp chất) điều chế được bao nhiêu kg vôi sống, biết rằng hiệu suất toàn bộ quá trình là 75%?
Lời giải
CaCO3 → CaO + CO2↑
Theo phương trình 100(g) → 56 (g)
Hay 100 kg → 56 (kg)
Theo đề bài 10 kg → x (kg)
=> x = 10.56/100 = 5,6 (kg)
Vì H= 75% => lượng CaO thực tế thu được là: mCaO = 5,6. 75% : 100% = 4,2 (kg)
Đáp án: C
Bài 6: Khi cho CaO vào nước thu được
A. dung dịch CaO.
B. dung dịch Ca(OH)2.
C. chất không tan Ca(OH)2.
D. cả B và C.
Lời giải
Khi cho CaO vào nước xảy ra phản ứng: CaO + H2O → Ca(OH)2
Vì Ca(OH)2 là chất ít tan trong nước, phần tan tạo thành dung dịch bazơ và còn 1 phần không tan lắng xuống
Đáp án: D
Bài 7: Ứng dụng nào sau đây không phải của canxi oxit?
A. Công nghiệp sản suất cao su
B. Sản xuất thủy tinh.
C. Công nghiệp xây dựng, khử chua cho đất.
D. Sát trùng diệt nấm, khử độc môi trường.
Lời giải
CaO được dùng trong công nghiệp sản xuất thủy tinh; khử chua đất trồng trọt; xử lí nước thải của các nhà máy.
=> Ứng dụng không phải của canxi oxit là: công nghiệp luyện kim
Đáp án: A
Bài 8: Hóa chất nào sau đây dùng để khử chua đất trong công nghiệp?
A. CaCO3
B. MgCO3
C. NaCl
D. CaO
Lời giải
Đất chua là đất có môi trường axit => dùng hóa chất có tính bazơ để trung hòa bớt độ chua của đất
CaO + H2O → Ca(OH)2 (môi trường bazơ)
Ca(OH)2 trung hòa lượng H+ trong đất làm đất bớt chua
Đáp án: D
Bài 9: Canxi oxit có thể tác dụng được với những chất nào sau đây?
A. H2O, CO2, HCl, H2SO4
B. CO2, HCl, NaOH, H2O
C. Mg, H2O, NaCl, NaOH
D. CO2, HCl, NaCl, H2O
Lời giải
Canxi oxit có thể tác dụng được với : H2O, CO2, HCl, H2SO4.
Đáp án: A
Bài 10: Các oxit tác dụng được với nước là
A. PbO2, K2O, SO3
B. BaO, K2O, SO2
C. Al2O3, NO, SO2
D. CaO, FeO, NO2
Lời giải
Các oxit tác dụng được với nước là BaO, K2O, SO2.
BaO + H2O → Ba(OH)2
K2O + H2O → 2KOH
SO2 + H2O ⇆ H2SO3
Đáp án: B
Bài 11: Hòa tan 0,56 gam CaO vào 800 ml nước thu được dung dịch nước vôi trong có nồng độ mol là
A. 0,15M
B. 0,0125M
C. 0,015M
D. 0,0025M
Lời giải
nCaO = 0,01 mol
CaO + H2O → Ca(OH)2
0,01 → 0,01
Đáp án: B
Bài 12: Để nhận biết hai khí SO2 và O2 ta dùng
A. quỳ tím ẩm
B. dung dịch Ca(OH)2
C. dung dịch Ba(OH)2
D. cả A, B, C đều đúng
Lời giải
Để nhận biết hai khí SO2 và O2 ta có thể dùng:
- Qùy tím ẩm: SO2 làm quỳ chuyển đỏ, O2 không đổi màu
- Dung dịch Ca(OH)2 hoặc Ba(OH)2: SO2 làm dung dịch xuất hiện vẩn đục, O2 không hiện tượng
Đáp án: D
Bài 13: Khí X là một khí có mùi hắc, khi dẫn khí X vào dung dịch nước vôi trong thì xuất hiện vẩn đục. Hỏi khí X là khí nào?
A. CO2
B. SO2
C. H2
D. H2S
Lời giải
X là một khí có mùi hắc, khi dẫn khí X vào dung dịch nước vôi trong thì xuất hiện vẩn đục → X là SO2 vì
SO2 + Ca(OH)2 → CaSO3 + H2O
Đáp án: B
Bài 14: Cho 8 gam lưu huỳnh trioxit (SO3) tác dụng với H2O, thu được 250 ml dung dịch axit sunfuric (H2SO4). Nồng độ mol của dung dịch axit thu được là
A. 0,1M
B. 0,4M
C. 0,5M
D. 0,6M
Lời giải
SO3 + H2O → H2SO4
0,1 → 0,1 mol
Đáp án: B
Bài 15: Hòa tan hết m gam SO3 vào nước thu được 98 gam dung dịch axit sunfuric có nồng độ 12,5%. Khối lượng m gam SO3 là:
A. 20g
B. 15g
C. 25g
D. 10g
Lời giải
Đáp án: D
Câu 16: Dẫn hỗn hợp khí gồm CO2, CO, SO2 lội qua dung dịch nước vôi trong (dư), khí thoát ra là:
A. CO
B. CO2
C. SO2
D. CO2 và SO2
Dung dịch nước vôi trong là Ca(OH)2 là dung dịch bazơ
=> Oxit axit có thể tác dụng với dung dịch bazơ, đó là CO2 và SO2 và 2 khí này bị hấp thụ trong dd
CO không tác dụng vì CO là oxit trung tính.
=> Khí thoát ra là CO
Đáp án: A
Câu 17: Hòa tan vừa đủ 5,6 gam CaO vào dung dịch HCl 14,6% . Khối lượng dung dịch HCl đã dùng là :
A. 60 gam
B. 40 gam
C. 50 gam
D. 73
Đáp án: C
Câu 18: Cho 9,3 gam Na2O tác dụng hết với 200 ml dung dịch HCl aM sau phản ứng thu được muối m gam muối natriclorua. Giá trị của a và m là:
A. a = 1,5 M và m = 8,775g
B. a = 1,5 M và m = 17,55g
C. a = 2 M và m = 8,775g
D. a = 2 M và m = 8,775g
Đáp án: B
Câu 19: Hòa tan 2,4 gam oxit của một kim loại hóa trị II vào 21,9 gam dung dịch HCl 10% thì vừa đủ. Oxit đó là:
A. CuO
B. CaO
C. MgO
D. FeO
Đáp án: A
Câu 20: Hòa tan 8 gam oxit của một kim loại hóa trị II vào 98 gam dung dịch H2SO4 20% thì vừa đủ . Oxit đó là:
A. CuO
B. CaO
C. MgO
D. FeO
Đáp án: C
Xem thêm các dạng bài tập hay khác:
30 bài tập về Một số muối quan trọng (2024) có đáp án chi tiết nhất
30 Bài tập về Tính chất hóa học của oxit. Khái quát về sự phân loại oxit (2024)
30 Bài tập về Các oxit của cacbon (2024) có đáp án chi tiết nhất
30 bài tập về Một số muối quan trọng (2024) có đáp án chi tiết nhất
30 Bài tập về Tính chất hóa học của bazơ (2024) có đáp án chi tiết nhất