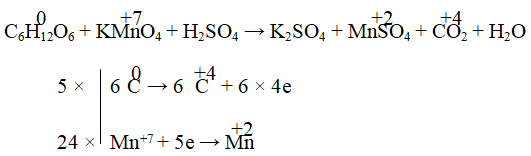Bài tập cân bằng phương trình hóa học
I. Lí thuyết và phương pháp giải
Cân bằng phương trình hóa học được dựa trên nguyên tắc: Tổng số electron nhường và tổng số electron nhận bằng nhau.
Bước 1: Xác định số oxi hóa có sự thay đổi như thế nào.
Bước 2: Tiến hành lập thăng bằng electron.
Bước 3: Sau khi đã tìm được hệ số, các em hãy đặt hệ số vào phản ứng để tính các hệ số còn lại.
Lưu ý:
- Với các phản ứng oxi hóa – khử, ngoài phương pháp thăng bằng electron, các em có thể cân bằng phương trình phản ứng theo phương pháp tăng – giảm số oxi hóa, dựa trên nguyên tắc tổng số oxi hóa tăng và giảm bằng nhau.
- Phản ứng oxi hóa – khử còn có thể cân bằng theo phương pháp ion – electron. Phương pháp này vẫn đảm bảo nguyên tắc thăng bằng electron, tuy nhiên, các nguyên tố sẽ được viết ở dạng ion đúng, ví dụ: SO42-, NO3–, Cr2O72-,MnO4–,…
- Một phương trình oxi – hóa khử nếu có nhiều nguyên tố có số oxi hóa cùng tăng hoặc cùng giảm mà:
+ Chúng cùng thuộc 1 chất thì các em cần đảm bảo tỷ lệ số nguyên tử của các nguyên tố trong phân tử.
+ Chúng thuộc các chất khác nhau thì các em phải đảm bảo tỉ lệ mol của các chất đó theo đề bài.
- Đối với hợp chất hữu cơ:
+ Nếu hợp chất hữu cơ trước và sau phản ứng chỉ có một nhóm nguyên tử thay đổi và một số nhóm không thay đổi thì các em nên xác định số oxi hóa của C ở từng nhóm rồi mới thực hiện cân bằng phương trình hóa học.
+ Nếu hợp chất hữu cơ thay đổi toàn bộ phân tử thì các em nên cân bằng theo số oxi hóa trung bình của C.
II. Ví dụ minh họa
Ví dụ 1. Cân bằng phản ứng trong dung dịch bazơ:
NaCrO2 + Br2 + NaOH → Na2CrO4 + NaBr
Hướng dẫn:
CrO2- + 4OH- → CrO42- + 2H2O + 3e
Br2 + 2e → 2Br-
Phương trình ion:
2CrO2- + 8OH- + 3Br2 → 2CrO42- + 6Br- + 4H2O
Phương trình phản ứng phân tử:
2NaCrO2 + 3Br2 + 8NaOH → 2Na2CrO4 + 6NaBr + 4H2O
Ví dụ 2. Cân bằng phản ứng trong dung dịch có H2O tham gia:
KMnO4 + K2SO3 + H2O → MnO2 + K2SO4
Hướng dẫn:
MnO4- + 3e + 2H2O → MnO2 + 4OH-
SO32- + H2O → SO42- + 2H+ + 2e
Phương trình ion:
2MnO4- + H2O + 3SO32- → 2MnO2 + 2OH- + 3SO42-
Phương trình phản ứng phân tử:
2KMnO4 + 3K2SO3 + H2O → 2MnO2 + 3K2SO4 + 2KOH
Ví dụ 3. Cân bằng phản ứng oxi hóa – khử sau:
C6H12O6 + KMnO4 + H2SO4 → K2SO4 + MnSO4 + CO2 + H2O
Hướng dẫn:
5C6H12O6 + 24KMnO4 + 36H2SO4 → 12K2SO4 + 24MnSO4 + 30CO2 + 66H2O
III. Bài tập vận dụng
Câu 1. Cho phản ứng: FeSO4 + K2Cr2O7 + H2SO4 → Fe2(SO4)3 + K2SO4 + Cr2(SO4)2 + H2O. Cho biết hệ số cân bằng của FeSO4 và K2Cr2O7 lần lượt là bao nhiêu?
A. 5; 2
B. 6; 2
C. 6; 1
D. 8; 3
Lời giải
Đáp án C
6FeSO4 + K2Cr2O7 + 7H2SO4→ 3Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + 7H2O
Câu 2. Trong phản ứng dưới đây, vai trò của H2S là:
2FeCl3 + H2S → 2FeCl2 + S + 2HCl
A. Chất oxi hóa.
B. chất khử.
C. Axit.
D. Vừa oxi hóa vừa khử.
Lời giải
Đáp án D
Vừa oxi hóa vừa khử.
Câu 3. Trong phản ứng nào dưới đây HCl thể hiện tính oxi hoá?
A. HCl + AgNO3 → AgCl + HNO3
B. 2HCl + Mg → MgCl2 + H2
C. 8HCl + Fe3O4 → FeCl2 + 2FeCl3 + 4H2O
D. 4HCl + MnO2 → MnCl2+ Cl2 + 2H2O
Lời giải
Đáp án B
Câu 4. Trong phản ứng dưới đây, vai trò của HCl là:
MnO2 + 4HCl → MnCl2 + Cl2+ 2H2O
A. oxi hóa.
B. chất khử.
C. tạo môi trường.
D. chất khử và môi trường.
Lời giải
Đáp án D
Câu 5. Cho amoniac NH3 tác dụng với oxi ở nhiệt độ cao có xúc tác thích hợp sinh ra nitơ oxit NO và nước. Phương trình hoá học: 4NH3+ 5O2 → 4NO + 6H2O. Trong phản ứng trên, NH3 đóng vai trò
A. là chất oxi hoá.
B. là chất khử.
C. là một bazơ.
D. là một axit.
Lời giải
Đáp án B
Xem thêm các dạng bài tập Hóa Học hay khác:
30 Bài tập về Phương trình tốc độ phản ứng và hằng số tốc độ phản ứng (2024) có đáp án chi tiết nhất
30 bài tập về biến thiên Enthalpy trong các phản ứng hóa học (2024) có đáp án chi tiết nhất
30 Bài tập về Các yếu tố ảnh hưởng đến tốc độ phản ứng hóa học (2024) có đáp án chi tiết nhất
30 Bài tập về Khái niệm về cân bằng hoá học (2024) có đáp án chi tiết nhất