Bài tập cân bằng phương trình hóa học bằng phương pháp thăng bằng electron
1. Lý thuyết và phương pháp giải
1.1 Quy tắc xác định số Oxi hóa
● Quy tắc 1: Số oxi hóa của các nguyên tố trong đơn chất bằng 0.
● Quy tắc 2: Trong hầu hết các hợp chất :
- Số oxi hóa của H là +1 (trừ các hợp chất của H với kim loại như NaH, CaH2, thì H có số oxi hóa –1).
- Số oxi hóa của O là –2 (trừ một số trường hợp như H2O2, F2O, oxi có số oxi hóa lần lượt là : –1, +2).
● Quy tắc 3: Trong một phân tử, tổng đại số số oxi hóa của các nguyên tố bằng 0. Theo quy tắc này, ta có thể tìm được số oxi hóa của một nguyên tố nào đó trong phân tử nếu biết số oxi hóa của các nguyên tố còn lại.
● Quy tắc 4:Trong ion đơn nguyên tử, số oxi hóa của nguyên tử bằng điện tích của ion đó. Trong ion đa nguyên tử, tổng đại số số oxi hóa của các nguyên tử trong ion đó bằng điện tích của nó.
> Chú ý:
Để biểu diễn số oxi hóa thì viết dấu trước, số sau, còn để biểu diễn điện tích của ion thì viết số trước, dấu sau.
Ví dụ: Số oxi hóa Fe+3 còn ion sắt (III) ghi Fe3+.
Nếu điện tích là 1+ (hoặc 1–) có thể viết đơn giản là + (hoặc -) thì đối với số oxi hóa phải viết đầy đủ cả dấu và chữ (+1 hoặc –1).
Trong hợp chất, số oxi hóa của kim loại kiềm luôn là +1, kiềm thổ luôn là +2 và nhôm luôn là +3.
1.2 Phương pháp giải
Bước 1. Xác định số oxi hoá của những nguyên tố thay đổi số oxi hoá
Bước 2. Viết quá trình oxi hoá và quá trình khử, cân bằng mỗi quá trình:
+ Dấu "+e" đặt bên có số oxi hoá lớn.
+ Số e = số oxi hoá lớn - số oxi hoá bé.
+ Nhân cả quá trình với chỉ số của nguyên tố thay đổi số oxi hoá nếu chỉ số khác 1 (với các đơn chất có thể chấp nhận giữ nguyên chỉ số).
Bước 3: Tìm hệ số thích hợp sao cho tổng số e cho bằng tổng số e nhận:
+ Tìm bội chung nhỏ nhất của số e nhường và nhận.
+ Lấy bội chung nhỏ nhất chia cho số e ở từng quá trình được hệ số.
Bước 4. Đặt hệ số của chất oxi hoá và chất khử vào sơ đồ phản ứng và kiểm tra lại.
2. Ví dụ minh hoạ
Ví dụ 1. Cân bằng phản ứng oxi hóa – khử sau:
P + O2 → P2O5
Hướng dẫn cân bằng phản ứng oxi hóa khử
P0 + O02 → P+52O-25
|
Quá trình oxi hóa Quá trình khử |
P0 → P+5 +5e O20 + 2e → 2O-2 |
|
x4 x5 |
P0 → P+5 +5e O20 + 2e → 2O-2 |
4P + 5O2 → 2P2O5
Ví dụ 2. Cân bằng phản ứng oxi hóa – khử sau:
Cu + HNO3→ Cu(NO3)2 + NO + H2O
Hướng dẫn cân bằng phản ứng oxi hóa khử
Cuo + HN+5O3→ Cu+2(NO3)2+ N+2O + H2O
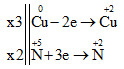
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
3. Bài tập vận dụng
Bài 1. Cho 5,6 gam Fe tan hoàn toàn trong dung dịch H2SO4 đặc nóng, sau phản ứng thu được V lít SO2 (đktc, sản phẩm khử duy nhất). Giá trị của V là:
A. 6,72 lít
B. 3,36 lít
C. 4,48 lít
D. 2,24 lít
Hướng dẫn giải chi tiết
nFe= 5,6/56=0,1 mol
Quá trình nhường e
Fe0 → Fe+3 + 3e
0,1 → 0,3
Quá trình nhận e
S+6 + 2e → S+4
0,3 0,15
=> VSO2 = 0,15.22,4 = 3,36 lít
Bài 2. Cho 11,2 gam Fe tan hoàn toàn trong dung dịch HNO3 loãng dư, sau phản ứng thu được V lít NO (đktc, sản phẩm khử duy nhất). Giá trị của V là:
A. 6,72 lít
B. 2,24 lít
C. 3,36 lít
D. 4,48 lít
Hướng dẫn giải chi tiết
Số mol của sắt bằng:
nFe = 0,2 mol.
Phương trình phản ứng minh họa liên quan
Fe + 4HNO3 → Fe(NO3)3 + NO↑+ 2H2O
=> nNO = 0,2
=> VNO = 0,2.22,4 = 4,48 lít.
Bài 3. Hoà tan m gam hỗn hợp gồm Al, Fe vào dung dịch H2SO4 loãng (dư). Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch X. Cho dung dịch Ba(OH)2 (dư) vào dung dịch X, thu được kết tủa Y. Nung Y trong không khí đến khối lượng không đổi, thu được chất rắn Z là:
A. hỗn hợp gồm Al2O3 và Fe2O3
B. hỗn hợp gồm BaSO4 và Fe2O3
C. hỗn hợp gồm BaSO4 và FeO
D. Fe2O3
Hướng dẫn giải chi tiết
Phương trình phản ứng hóa học
2Al + 3H2SO4 → Al2(SO4)3 + 3H2
Fe + H 2SO4 → FeSO4 + H2
Dung dịch X gồm Al2(SO4)3 và FeSO4 + Ba(OH)2
Ba(OH)2 + Al2(SO4)3 → BaSO4↓ + Al(OH)3↓
Ba(OH)2 + Al(OH)3 → Ba(AlO2)2 + H2O
Ba(OH)2 + FeSO4 → Fe(OH)2↓ + BaSO4↓
Nung kết tủa Y được Fe2O3 và BaSO4
Bài 4. Cho phản ứng: FeSO4 + K2Cr2O7 + H2SO4 → Fe2(SO4)3 + K2SO4 + Cr2(![]() )2 + H2O. Cho biết hệ số cân bằng của FeSO4 và K2Cr2O7 lần lượt là bao nhiêu?
)2 + H2O. Cho biết hệ số cân bằng của FeSO4 và K2Cr2O7 lần lượt là bao nhiêu?
A. 5; 2 B. 6; 2 C. 6; 1 D. 8; 3
Đáp án C
Bài 5. Cho phản ứng: Na2SO3 + KMnO4 + H2O → Na2SO4 + MnO2 + KOH
Hãy cho biết tỉ lệ hệ số của chất khử và chất oxi hóa sau khi cân bằng là đáp án nào dưới đây?
A. 4:3 B. 3:4 C. 3:2 D. 2:3
Đáp án C
Bài 6. Cân bằng phản ứng sau:
Fe3O4 + HNO3 → Fe(![]() )3 + NO + H2O
)3 + NO + H2O
Bài 7. Cân bằng phản ứng:
As2S3 + HNO3 + H2O → H3As![]() + NO + H2SO4
+ NO + H2SO4
Bài 8. Cân bằng phản ứng:
FexOy + HNO3 → Fe(![]() )3 + NO + H2O
)3 + NO + H2O
Xem thêm các dạng bài tập Hoá học 10 hay, chi tiết, đầy đủ khác:
30 Bài tập về Các yếu tố ảnh hưởng đến tốc độ phản ứng hóa học (2024) có đáp án chi tiết nhất
50 Bài tập thành phần của nguyên tử (2024) có đáp án chi tiết nhất
30 Bài tập về Mô hình nguyên tử và orbital nguyên tử (2024) có đáp án chi tiết nhất
30 Bài tập về Hydrogen halide và hydrohalic acid (2024) có đáp án chi tiết nhất
30 Bài tập về Tính chất vật lí và hóa học các đơn chất nhóm VIIA (2024) có đáp án chi tiết nhất




