Trắc Nghiệm Hóa Học 11 Bài 2: Cân bằng trong dung dịch nước
I. Trắc nghiệm:
Câu 1: Phương trình điện li nào sau đây không đúng?
A. HNO3→H++NO3−.
B. BaCl2 → Ba2+ + 2Cl-
C. HF ⇌ H+ + F−
D. K2SO4 ⇌ 2K+ + SO42-
Đáp án đúng là: D
K2SO4→2K++SO2−4
Câu 2: Cho phương trình:NH3 + H2O ⇌NH4+ + OH-
Trong phản ứng thuận, theo thuyết Bronsted – Lowry chất nào là base?
A. NH3.
B. H2O.
C. NH4+.
D. OH-.
Đáp án đúng là: A
Vì trong phản ứng trên theo chiều thuận, NH3 là chất nhận nên NH3 là base.
Câu 3: Cho phương trình:CH3COOH + H2O ⇌CH3COO- + H3O+
Trong phản ứng thuận, theo thuyết Bronsted – Lowry chất nào là acid?
A. CH3COOH.
B. H2O.
C. CH3COO-.
D. H3O+.
Đáp án đúng là: A
Vì trong phản ứng trên theo chiều thuận, CH3COOH là chất cho H+ nên CH3COOH là acid.
Câu 4: Theo thuyết Bronsted – Lowry, dãy các chất nào sau đây là base?
A. Fe2+, HCl, PO43-.
B. CO32-, SO32-, PO43-.
C. Na+, H+, Al3+.
D. Fe3+, Ag+, H2CO3.
Đáp án đúng là: B
CO2−3+H2O⇌HCO−3+OH−SO2−3+H2O⇌HSO−3+OH−PO3−4+H2O⇌HPO2−4+OH−
Các ion CO32-, SO32-, PO43- đều nhận H+từ nước nên đều là base.
Câu 5: Trong dung dịch nước, cation kim loại mạnh, gốc acid mạnh không bị thủy phân, còn cation kim loại trung bình và yếu bị thủy phân tạo môi trường acid, gốc acid yếu bị thủy phân tạo môi trường base. Dung dịch muối nào sau đây có pH > 7?
A. KNO3
B. K2SO4
C. Na2CO3
D. NaCl
Đáp án đúng là: C
Vì trong dung dịch Na2CO3 có gốc acid CO32-yếu: CO2−3+H2O⇌HCO−3+OH−
Câu 6: pH của dung dịch nào sau đây có giá trị nhỏ nhất?
A. Dung dịch HCl 0,1M
B. Dung dịch CH3COOH 0,1M
C. Dung dịch NaCl 0,1M
D. Dung dịch NaOH 0,01M
Đáp án đúng là: A
Vì NaOH là một base mạnh nên pH > 7, xét về nồng độ bằng nhau của các dung dịch còn lại thì HCl là một acid mạnh sẽ có giá trị pH nhỏ nhất.
Câu 7: Trong các dung dịch acid sau có cùng nồng độ 0,1 M, dung dịch nào có pH cao nhất?
A. HF.
B. HCl.
C. HBr.
D. HI.
Đáp án đúng là: A
HCl, HBr, HI là các acid mạnh, HF là acid yếu nên sẽ có pH cao nhất.
Câu 8: Đo pH của một cốc nước chanh được giá trị pH bằng 2,4. Nhận định nào sau đây không đúng?
A. Nước chanh có môi trường acid.
B. Nồng độ ion [H+] của nước chanh là 10-2,4 mol/L.
C. Nồng độ ion [H+] của nước chanh là 0,24 mol/L.
D. Nồng độ ion [OH-] của nước chanh nhỏ hơn 10-7 mol/L.
Đáp án đúng là: C
Cốc nước chanh được giá trị pH bằng 2,4 nên nồng độ ion [H+] của nước chanh là 10-2,4 = 0,004 mol/L.
Câu 9: Giá trị pH của dung dịch HCl 0,001M là
A. 3.
B. 11.
C. 12.
D. 2.
Đáp án đúng là: A
Nồng độ ion [H+] của dung dịch HCl 0,001M là 10-3 = 0,001 mol/L nên giá trị pH của dung dịch HCl 0,001 là 3.
Câu 10: Dung dịch nào sau đây có khả năng dẫn điện?
A. Dung dịch saccharose.
B. Nước muối.
C. Dung dịch ethanol.
D. Nước tinh khiết.
Đáp án đúng là: B
Trong nước muối, phân tử NaCl phân li trong nước tạo các ion Na+,Cl− nên dung dịch này dẫn điện.
Câu 11: Chất nào sau đây là chất điện li?
A. Cl2.
B. HNO3.
C. MgO.
D. CH4.
Đáp án đúng là: B
Trong nước, HNO3 phân li: HNO3(aq)→H+(aq)+NO−3(aq)nên HNO3 là chất điện li.
Câu 12: Chất nào sau đây không phải chất điện li?
A. KOH.
B. H2S.
C. HNO3.
D. C2H5OH.
Đáp án đúng là: D
Vì các chất điện li là KOH, H2S, HNO3
Câu 13: Chất nào sau đây thuộc loại chất điện li mạnh?
A. CO2.
B. NaOH.
C. H2O.
D. H2S.
Đáp án đúng là: B
Vì NaOH là một base mạnh, các phân tử đều phân li ra ion:
NaOH→Na++OH−
Câu 14: Chất nào sau đây thuộc loại chất điện li yếu?
A. KCl.
B. HF.
C. HNO3.
D. NH4Cl.
Đáp án đúng là: B
HF là một acid yếu: HF⇌H++F−
Câu 15: Phương trình điện li viết đúng là
A. NaCl→Na2++Cl2−.
B. C2H5OH→C2H5++OH−
C. KOH → K+ + OH−.
D. CH3COOH→CH3COO−+H+.
Đáp án đúng là: C
NaCl→Na++Cl−CH3COOH⇌CH3COO−+H+
Ethanol không điện li.
II. Tóm tắt lý thuyết:
I. Sự điện li
1. Hiện tượng điện li
Quá trình phân li các chất trong nước tạo thành ion được gọi là sự điện li. Những chất khi tan trong nước phân li ra ion được gọi là chất điện li.
Ví dụ: Sự phân li của NaCl trong nước
NaCl là hợp chất ion, trong tinh thể có các ion Na+ và Cl− liên kết với nhau bằng lực hút tĩnh điện. Nước là một dung môi phân cực. Khi cho các tinh thể NaCl vào nước, các ion Na+ và Cl− trên bề mặt hút các phân tử nước lại gần. Các phân tử nước hướng các đầu âm vào ion Na+, các đầu dương vào ion Cl− và làm yếu các liên kết giữa các cation, anion trong tinh thể và khuếch tán vào nước.
Quá trình trên được biểu diễn đơn giản bằng phương trình điện li:
NaCl (aq) → Na+ (aq) + Cl− (aq).
2. Chất điện li
a. Chất điện li và chất không điện li
- Chất điện li là chất khi tan trong nước phân li ra các ion.
Ví dụ: hydrochloric acid (HCl); sodium hydroxide (NaOH); sodium chloride (NaCl) …
Sự phân li một chất thành các ion mang điện tích trái dấu trong dung dịch được biểu diễn bằng phương trình điện li.
Ví dụ:
NaOH (aq) → Na+ (aq) + OH− (aq).
HCl (aq) → H+ (aq) + Cl− (aq).
- Chất không điện li là chất khi tan trong nước không phân li ra ion.
Ví dụ: Saccarose, ethanol …
b. Chất điện li mạnh và chất điện li yếu
Dựa vào mức độ phân li thành các ion, chất điện li được chia thành hai loại:
- Chất điện li mạnh là chất khi tan trong nước, hầu hết các phân tử chất tan đều phân li ra ion.
Các chất điện li mạnh thường gặp là:
+ Các acid mạnh: HCl, HNO3, H2SO4, …
+ Các base mạnh: NaOH, KOH, Ca(OH)2, Ba(OH)2 …
+ Hầu hết các muối.
Quá trình phân li của chất điện li mạnh xảy ra gần như hoàn toàn và được biểu diễn bằng mũi tên một chiều. Ví dụ:
HNO3 → H+ + NO-3
NaOH → Na+ + OH−
Na2CO3 → 2Na+ + CO2-3
- Chất điện li yếu là chất khi tan trong nước chỉ có một phần số phân tử chất tan phân li ra ion, phần còn lại vẫn tồn tại ở dạng phân tử trong dung dịch.
Những chất điện li yếu bao gồm:
+ Các acid yếu như: CH3COOH, HClO, HF, H2CO3 …
+ Các base yếu như: Cu(OH)2, Fe(OH)2 …
Quá trình phân li của chất điện li yếu là một phản ứng thuận nghịch và được biểu diễn bằng hai nửa mũi tên ngược chiều nhau:
CH3COOH ⇌ CH3COO− + H+
II. Thuyết acid – base của Bronsted – Lowry
1. Khái niệm acid – base theo thuyết Bronsted – Lowry
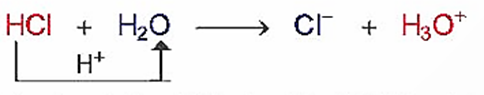
Thuyết Bronsted – Lowry cho rằng acid là chất cho proton (H+) và base là chất nhận proton.
Ví dụ:
Trong phản ứng này: HCl cho H+, HCl là acid; H2O nhận H+, H2O là base.
2. Ưu điểm của thuyết Bronsted – Lowry
Theo thuyết Arrhenius, trong phân tử acid phải có nguyên tử H, trong nước phân li ra ion H+, trong phân tử base phải có nhóm OH, trong nước phân li ra ion OH−.
Thuyết Arrhenius chỉ đúng trong trường hợp dung môi là nước.
Thuyết Bronsted – Lowry tổng quát hơn thuyết Arrhenius, phân tử không có nhóm OH− như NH3 hoặc ion CO2-3cũng là base.
III. Khái niệm pH và ý nghĩa của pH trong thực tiễn
1. Khái niệm pH
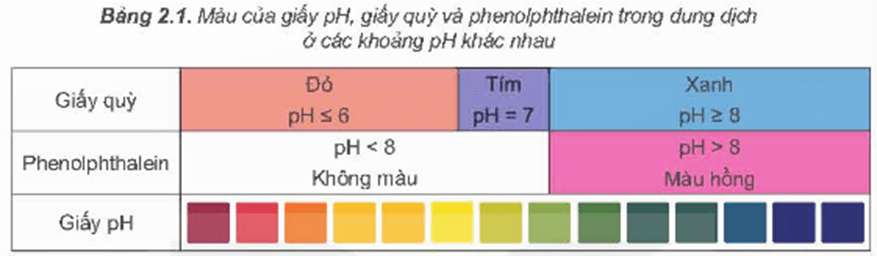
pH là chỉ số đánh giá độ acid hay độ base của một dung dịch với quy ước như sau:
pH = -log[H+] hoặc [H+] = 10-pH
Trong đó [H+] là nồng độ mol của ion H+.
Nếu dung dịch có [H+] = 10-a thì pH = a.
Chú ý:
+ Môi trường acid có pH < 7.
+ Môi trường base có pH > 7.
+ Môi trường trung tính có pH = 7.
Thang pH thường có giá trị từ 1 đến 14.
2. Ý nghĩa của pH trong thực tiễn
Chỉ số pH có ý nghĩa to lớn trong thực tiễn, pH có liên quan đến sức khoẻ của con người, sự phát triển của động vật, thực vật,…
Ví dụ:
+ Chỉ số pH trong nước tiểu thường trong khoảng 4,8 – 7. Nếu pH nước tiểu cao trên 8 thì có thể bệnh nhân đang mắc một số bệnh như sỏi thận, nhiễm trùng đường tiết niệu …
+ Một số động vật sống dưới nước cần có môi trường có giá trị pH thích hợp, ví dụ: tôm và cá ưa sống trong môi trường nước có pH khoảng 7,5 đến 8,5.
+ Một số loài thực vật chỉ phát triển tốt trong đất có giá trị pH thích hợp, ví dụ cây chè ưa sống trong đất có pH từ 4,5 – 5,5.
3. Xác định pH
Giá trị pH của dung dịch được xác định gần đúng bằng cách sử dụng chất chỉ thị acid – base. Khi cần xác định giá trị pH chính xác hơn, người ta sử dụng máy đo pH.
IV. Sự thuỷ phân của các ion
Khi tan trong nước, muối phân li thành các ion. Phản ứng giữa ion với nước tạo ra các dung dịch có môi trường khác nhau được gọi là phản ứng thuỷ phân.
Ví dụ:
Trong dung dịch Na2CO3, ion Na+ không bị thuỷ phân, còn ion CO2-3 bị thuỷ phân trong nước tạo OH− theo phương trình:
CO2-3+H2O⇌HCO-3+OH-
Vì vậy, dung dịch Na2CO3 có môi trường base. Na2CO3 được sử dụng trong công nghiệp thực phẩm, dệt, nhuộm, công nghệ thuỷ tinh, silicate,…
V. Chuẩn độ acid – base
Chuẩn độ là phương pháp xác định nồng độ của một chất bằng một dung dịch chuẩn đã biết nồng độ. Dựa vào thể tích của các dung dịch khi phản ứng vừa đủ với nhau, xác định được nồng độ dung dịch chất cần chuẩn độ.
Ví dụ:
Trong phòng thí nghiệm, nồng độ của dung dịch base mạnh (NaOH) được xác định bằng một dung dịch acid mạnh (HCl) đã biết trước nồng độ mol dựa trên phản ứng:
NaOH + HCl → NaCl + H2O
Khi các chất phản ứng vừa đủ với nhau, số mol HCl phản ứng bằng số mol NaOH.
Ta có:
VHCl. CHCl = VNaOH. CNaOH
Trong đó:
+ CHCl, CNaOH lần lượt là nồng độ mol của dung dịch HCl và NaOH.
+ VHCl, VNaOH lần lượt là thể tích của dung dịch HCl và NaOH (cùng đơn vị đo).
Khi biết VHCl, VNaOH trong quá trình chuẩn độ và biết CHCl sẽ tính được CNaOH.
Xem thêm tóm tắt lý thuyết Hóa học lớp 11 Kết nối tri thức hay khác:
Trắc nghiệm Hóa học 11 Bài 1: Khái niệm về cân bằng hoá học