Video 5 điều cần biết khi tiêm vắc xin Pfizer
- Các nhà khoa học trên khắp thế giới đã phát triển vắc xin và các phương pháp điều trị cho căn bệnh coronavirus mới được gọi là COVID-19.
- Một vài công ty đang nghiên cứu các loại thuốc kháng vi-rút, một số đã được sử dụng để điều trị các bệnh khác điều trị cho những người mắc COVID-19.
- Hiện tại, có ba loại vắc-xin được sử dụng để phòng ngừa căn bệnh này được phân phối tại Hoa Kỳ.
Vào ngày 22 tháng 10 năm 2020, Cơ quan Quản lý Thực phẩm và Dược phẩm (FDA) đã cho phép Veklury (remdesivir) trở thành loại thuốc đầu tiên được phê duyệt để điều trị COVID-19. Thuốc được chỉ định sử dụng cho người lớn và trẻ em từ 12 tuổi trở lên.
Cơ quan này cũng đã cấp giấy phép sử dụng trong trường hợp khẩn cấp (EUA) cho một số phương pháp điều trị khác, bao gồm cả phương pháp điều trị bằng huyết tương, phương pháp an thần cho những người được đặt máy thở và phương pháp siêu lọc máu liên tục cho những người đang phải trải qua quá trình lọc máu.
EUA cho phép các bác sĩ sử dụng các loại thuốc này để điều trị cho mọi người ngay cả trước khi các loại thuốc đó được phê duyệt chính thức bởi FDA.
Trong lúc chờ đợi các phương pháp điều trị khác và chờ cho vắc xin được phê duyệt chính thức để cung cấp cho người dân, vẫn còn những cách khác để bảo vệ bản thân và những người khác khỏi chủng coronavirus này. “Mặc dù tiến bộ công nghệ cho phép chúng ta điều trị bệnh với các biện pháp mới nhanh hơn, chúng ta vẫn cần phải thực hiện giãn cách xã hội, truy vết, tự cách ly và các biện pháp khác,” Tiến sĩ Bruce Y. Lee, giáo sư tại Trường Cao học CUNY về Chính sách Y tế & Sức khỏe Cộng đồng, phát biểu với Healthline.
Các loại vắc-xin phòng ngừa covid-19
Vắc xin là chế phẩm sinh học được sản xuất để bảo vệ mọi người trước khi phơi nhiễm với vi rút, trong trường hợp này là SARS-CoV-2.
Về cơ bản, vắc-xin huấn luyện hệ thống miễn dịch để có thể nhận ra và tấn công một loại vi-rút, ngay cả một loại vi-rút mà nó chưa từng thấy trước đây. Cho dù vắc-xin bắt chước cơ chế gây bệnh của của virus, chúng gần như không bao giờ gây bệnh.
Vắc xin cũng bảo vệ cộng đồng bằng cách giảm sự lây lan bệnh giữa người với người. Sự bảo vệ này được gọi là miễn dịch cộng đồng.
Dưới đây là một số dự án vắc xin COVID-19 đang được thực hiện:
Moderna / Viện Y tế Quốc gia. Công ty đã bắt đầu thử nghiệm vắc xin RNA thông tin (mRNA) hai liều vào tháng 3 trong một thử nghiệm lâm sàng giai đoạn 1, với kết quả đầy hứa hẹn.
Vào cuối tháng 7, Moderna bắt đầu thử nghiệm lâm sàng giai đoạn 3 của loại vắc-xin này.
Vào cuối tháng 8, các quan chức của công ty cho biết dữ liệu thử nghiệm giai đoạn 1 sơ bộ cho thấy vắc xin này đã tạo ra phản ứng miễn dịch đầy hứa hẹn ở 10 người trong độ tuổi từ 56 đến 70 cũng như 10 người trên 70 tuổi.
Công ty đã thông báo vào cuối tháng 10 rằng họ đã hoàn thành việc lựa chọn 30.000 tình nguyện viên tham gia thử nghiệm giai đoạn 3 bao gồm hơn 7.000 người trên 65 tuổi và hơn 5.000 người trẻ mắc các bệnh mãn tính làm nguy cơ mắc COVID-19 nặng.
Vào đầu tháng 10, các quan chức công ty thông báo vắc xin của họ sẽ không được phân phối rộng rãi cho đến mùa xuân năm 2021.
Vào giữa tháng 11, các quan chức Moderna báo cáo rằng vắc xin của họ đã đạt được tỷ lệ hiệu quả là 94% trong kết quả thử nghiệm giai đoạn 3.
Vào ngày 18 tháng 12, FDA đã cấp một giấy phép sử dụng khẩn cấp đối với vắc xin Moderna.
Vào ngày 25 tháng 5, các quan chức của công ty đã công bố vắc-xin của họ đã được chứng minh là có hiệu quả trong các thử nghiệm lâm sàng chống lại COVID-19 ở trẻ em từ 12 đến 17 tuổi.
Vào đầu tháng 6, các quan chức Moderna đã yêu cầu FDA cấp cho họ giấy phép sử dụng khẩn cấp để tiêm vắc xin của họ cho trẻ em từ 12 đến 17 tuổi.
Pfizer / BioNTech / Fosun Pharma.
Drugmaker Pfizer đã hợp tác với công ty công nghệ sinh học BioNTech của Đức và nhà sản xuất dược phẩm Fosun Pharma của Trung Quốc để phát triển vắc xin mRNA hai liều.
Vào giữa tháng 8, các quan chức của công ty cho biết vắc-xin đã tạo ra phản ứng “mạnh mẽ” trong một thử nghiệm lâm sàng giai đoạn 1/2.
Công ty đã tiến hành thử nghiệm giai đoạn ba trên 30.000 người từ Hoa Kỳ, Brazil, Argentina và Đức. Sau đó, họ đã công bố kế hoạch tăng con số này lên 44.000 người. Vào tháng 10, công ty cho biết họ đã nhận được sự chấp thuận cho trẻ em dưới 12 tuổi vào thử nghiệm - thử nghiệm đầu tiên của Mỹ bao gồm nhóm tuổi này.
Tính đến cuối tháng 10, cuộc thử nghiệm đã thu hút hơn 42.000 người tham gia. Vào thời điểm đó, công ty vẫn chưa thực hiện một phân tích tạm thời về nghiên cứu dữ dữ liệu, điều này khiến họ không đạt được mục tiêu ban đầu là tháng 9. Tuy nhiên, công ty vẫn hy vọng sẽ có đủ dữ liệu vào khoảng tháng 11 để xin cấp phép sử dụng khẩn cấp từ FDA.
Vào ngày 9 tháng 11 năm 2020, công ty thông báo rằng vắc-xin của họ đã có hiệu quả hơn 90% đối với những người tham gia thử nghiệm lâm sàng.
Vài ngày sau, các quan chức của công ty thông báo rằng họ đang xin cấp phép sử dụng khẩn cấp từ FDA cho vắc xin của họ. Đây là sự chấp thuận theo quy định đầu tiên ở Hoa Kỳ cho vắc-xin COVID-19. Các quan chức cho biết vắc-xin có thể được cung cấp cho các nhóm nguy cơ cao sớm nhất là vào giữa tháng 12.
Vào ngày 8 tháng 12, FDA đã công bố các tài liệu báo cáo rằng vắc-xin Pfizer cung cấp một số khả năng bảo vệ sau liều đầu tiên và bảo vệ gần như hoàn toàn sau liều thứ hai.
Vào ngày 11 tháng 12, FDA đã cấp phép sử dụng cho vắc xin Pfizer. Công ty bắt đầu phân phối sản phẩm sau đó hai ngày.
Vào cuối tháng 1 năm 2021 các quan chức của công ty cho biết một nghiên cứu chỉ ra rằng vắc xin của họ chỉ kém hiệu quả hơn một chút so với biến thể COVID-19 từ Nam Phi.
Vào giữa tháng 2, một nghiên cứu từ Israel đã báo cáo mức giảm 94% các trường hợp mắc bệnh COVID-19 có triệu chứng ở những người được tiêm cả hai liều vắc-xin Pfizer. Nghiên cứu đó cũng chỉ ra rằng vắc-xin này có hiệu quả 85% sau 15 đến 28 ngày sau tiêm liều đầu.
Vào giữa tháng 2, các quan chức của Pfizer thông báo rằng họ tin rằng vắc xin của họ có thể được bảo quản ở nhiệt độ tủ đông thông thường.
Vào cuối tháng 2, một nghiên cứu từ Vương quốc Anh đã báo cáo rằng một liều vắc-xin Pfizer có thể làm giảm 70% nguy cơ nhiễm coronavirus mới với tỷ lệ giảm 85% sau hai liều.
Vào đầu tháng 3, một nghiên cứu ở Israel đã báo cáo rằng vắc-xin Pfizer có hiệu quả cao trong việc ngăn ngừa COVID-19 ở những người mắc nhiều chứng bệnh, bao gồm béo phì, cao huyết áp và tiểu đường loại 2.
Vào giữa tháng 3, các quan chức của công ty công bố từ dữ liệu lâm sàng từ Israel, báo cáo rằng vắc xin của họ có hiệu quả 97% trong việc ngăn ngừa bệnh có triệu chứng do COVID-19.
Vào giữa tháng 5, FDA đã cấp phép sử dụng khẩn cấp cho vắc xin Pfizer được sử dụng cho trẻ em từ 12 tuổi đến 15 tuổi.
Vào đầu tháng 6, các quan chức của Pfizer thông báo họ sẽ bắt đầu thử nghiệm vắc xin trên trẻ em dưới 12 tuổi. Họ mong đợi kết quả từ những người tham gia thử nghiệm lâm sàng trong độ tuổi từ 5 đến 11 vào tháng 9.
Inovio.
Khi COVID-19 xuất hiện vào tháng 12, nhà sản xuất thuốc Inovio đã nghiên cứu vắc xin DNA cho MERS, do một loại coronavirus khác gây ra. Điều này cho phép công ty nhanh chóng phát triển một loại vắc-xin COVID-19 tiềm năng.
Các quan chức của công ty đã thông báo vào cuối tháng 4 rằng họ đã tuyển 40 tình nguyện viên khỏe mạnh trong giai đoạn 1 của thử nghiệm. Vào cuối tháng 9, công ty đã thông báo rằng thử nghiệm giai đoạn 2/3 của họ đang được tạm dừng để trả lời các câu hỏi của FDA về nghiên cứu.
Sanofi / Translate Bio. Drugmaker Sanofi đã thông báo vào tháng Hai rằng họ sẽ làm việc với Translate Bio để phát triển một loại vắc-xin mRNA. Thử nghiệm tiền lâm sàng cho thấy vắc-xin có thể tạo ra phản ứng miễn dịch mạnh mẽ ở chuột và khỉ. Công ty dự kiến sẽ có kết quả từ đợt thử nghiệm giai đoạn 2 vào đầu tháng 12. Sau đó, họ sẽ bắt đầu nghiên cứu giai đoạn 3.
CanSino Biologics.
Các nhà khoa học tại công ty Trung Quốc này cũng đang nghiên cứu một loại vắc-xin tiềm năng sử dụng một loại virus adenovirus được gọi là Ad5 để mang các protein coronavirus vào tế bào.
Vào cuối tháng 7, họ báo cáo rằng những người tham gia trong một thử nghiệm giai đoạn 2 cho thấy phản ứng miễn dịch mạnh mẽ khi được tiêm vắc-xin. Tuy nhiên, họ lưu ý rằng người lớn tuổi có phản ứng yếu hơn, cho thấy có thể cần hai liều ở nhóm tuổi đó.
Quân đội Trung Quốc đã phê duyệt loại vắc xin này vào tháng 6, cho phép tiêm vắc xin này cho các lực lượng vũ trang của họ. Vào tháng 8, công ty đã bắt đầu thử nghiệm giai đoạn 3 ở Pakistan, Ả Rập Saudi và Nga.
Viện nghiên cứu Gamaleya. Viện của Nga này đã phát triển một loại vắc-xin bao gồm hai adenovirus, Ad5 và Ad26.
Vào tháng 8, Tổng thống Vladimir Putin thông báo rằng cơ quan quản lý của đất nước đã phê duyệt vắc-xin này, ngay cả trước khi các thử nghiệm giai đoạn 3 bắt đầu. Các quan chức Nga sau đó cho biết loại vắc xin này đã nhận được “giấy chứng nhận đăng ký có điều kiện”.
Kết quả của một thử nghiệm giai đoạn 1/2 cho thấy vắc-xin tạo ra phản ứng miễn dịch với các tác dụng phụ nhẹ. Các thử nghiệm giai đoạn 3 hiện đang được tiến hành ở Nga, Belarus, Các Tiểu vương quốc Ả Rập Thống nhất và Ấn Độ.
Công ty dược phẩm Johnson & Johnson. Drugmaker
 Nguồn: The Guardian Johnson & Johnson đã thông báo vào cuối tháng 7 rằng họ đã bắt đầu thử nghiệm giai đoạn 1/2 ở người sau khi vắc-xin adenovirus của họ cho kết quả đầy hứa hẹn khi được sử dụng trên khỉ.
Nguồn: The Guardian Johnson & Johnson đã thông báo vào cuối tháng 7 rằng họ đã bắt đầu thử nghiệm giai đoạn 1/2 ở người sau khi vắc-xin adenovirus của họ cho kết quả đầy hứa hẹn khi được sử dụng trên khỉ.
Vào cuối tháng 9, công ty thông báo họ đang bắt đầu thử nghiệm giai đoạn 3 đối với vắc xin một liều của mình với 60.000 người tham gia. Vào giữa tháng 10, công ty thông báo họ sẽ tạm dừng cuộc thử nghiệm này do "bệnh không rõ nguyên nhân" với một trong những người tham gia. Công ty kể từ đó đã nhận được sự cho phép để bắt đầu nghiên cứu lại.
Vào giữa tháng 11, các quan chức của Johnson & Johnson cho biết họ dự kiến vắc xin của họ sẽ sẵn sàng để FDA phê duyệt vào tháng Hai.
Vào giữa tháng 1, các quan chức của công ty báo cáo rằng trong các thử nghiệm lâm sàng ban đầu, gần như tất cả những người tham gia đều phát triển phản ứng miễn dịch với vắc-xin và kéo dài ít nhất 71 ngày.
Vào cuối tháng 1, các quan chức của công ty đã thông báo rằng vắc-xin của họ có hiệu quả tổng thể là 66% và hiệu quả hơn 50% đối với các biến thể mới.
Vào đầu tháng 2, Johnson & Johnson đã yêu cầu cấp phép sử dụng khẩn cấp đối với vắc xin của mình. Các cơ quan quản lý của FDA sẽ kiểm tra dữ liệu trong những tuần tiếp theo vì đây là lần đầu tiên trong số các loại vắc xin một liều. Ban cố vấn của FDA dự kiến sẽ xem xét yêu cầu của công ty vào cuối tháng Hai.
Vào cuối tháng Hai, các quan chức của công ty đã thông báo rằng họ sẽ có thể cung cấp 20 triệu liều vắc xin vào cuối tháng Ba.
Vào cuối tháng 2, công ty đã nhận được giấy phép sử dụng khẩn cấp từ FDA cho vắc xin một liều của mình.
Vào đầu tháng 3, Nhà Trắng thông báo rằng Merck sẽ giúp Johnson & Johnson sản xuất vắc-xin để công ty có thể đạt được mục tiêu sản xuất.
AstraZeneca / Đại học Oxford.
Một thử nghiệm lâm sàng giai đoạn 1 tại Đại học Oxford đã bắt đầu vào cuối tháng Tư. Thuốc chủng này dựa trên adenovirus của tinh tinh, có tác dụng chuyển các protein coronavirus vào tế bào.
Vào tháng 8, AstraZeneca bắt đầu thử nghiệm giai đoạn 3 ở Brazil, Nam Phi và Hoa Kỳ. Các thử nghiệm này đã bị tạm dừng vào tháng 9 khi một tình nguyện viên nghiên cứu phát triển một chứng rối loạn viêm cột sống hiếm gặp được gọi là viêm tủy cắt ngang. Các thử nghiệm được bắt đầu lại một tuần sau đó ở Brazil và Vương quốc Anh. Vào cuối tháng 10, FDA đã cho phép cuộc thử nghiệm của Hoa Kỳ được tiếp tục.
Vào giữa tháng 11, các quan chức của công ty cho biết vắc xin của họ đã tạo ra phản ứng miễn dịch mạnh mẽ trong một thử nghiệm lâm sàng với những người trên 70 tuổi.
Dữ liệu được công bố vào ngày 8 tháng 12 chỉ ra rằng vắc-xin an toàn nhưng chỉ hiệu quả khoảng 70%.
Vào đầu tháng 2, các quan chức của công ty đã thông báo rằng kết quả thử nghiệm lâm sàng giai đoạn 3 cho thấy vắc xin của họ có hiệu quả 82% sau 12 tuần. Họ nói thêm rằng vắc-xin có hiệu quả 100% trong việc ngăn ngừa bệnh nặng, nhập viện và tử vong. Họ cũng lưu ý rằng vắc-xin đã đạt được hiệu quả lên đến 67% trong việc ngăn ngừa lây truyền bệnh tật.
Vài ngày sau, các quan chức Nam Phi đã đình chỉ kế hoạch tiêm chủng cho nhân viên y tế tuyến đầu của họ vì các thử nghiệm lâm sàng cho thấy vắc xin AstraZeneca không hiệu quả trong việc ngăn ngừa bệnh nhẹ đến trung bình với biến thể COVID-19 hiện đang chiếm ưu thế ở quốc gia đó.
Vào giữa tháng 2, Tổ chức Y tế Thế giới đã chấp thuận cấp giấy phép sử dụng khẩn cấp để vắc xin AstraZeneca được phân phối trên toàn thế giới.
Sanofi / GSK / TranslateBio. Drugmaker Sanofi đang theo đuổi hai loại vắc-xin. Công ty đang làm việc với nhà sản xuất thuốc GSK về một loại vắc-xin dựa trên protein từ coronavirus. Khi kết hợp với một hợp chất khác, được gọi là chất bổ trợ, các protein sẽ tạo ra phản ứng miễn dịch. Họ mong đợi kết quả từ thử nghiệm giai đoạn 2 vào đầu tháng 12, sau đó họ sẽ bắt đầu nghiên cứu giai đoạn 3.
Sanofi cũng đang làm việc với công ty công nghệ sinh học Translate Bio để phát triển vắc xin mRNA. Họ dự kiến sẽ bắt đầu thử nghiệm lâm sàng vào tháng 12.
Novavax.
 Nguồn: Time MagazineCông ty này đã nhận được khoản tài trợ lên tới 388 triệu đô la vào mùa xuân này từ Liên minh phòng chống các bệnh truyền nhiễm thời kì mới (CEPI), tài trợ cho việc phát triển vắc-xin COVID-19. Vắc xin được tạo ra bằng cách gắn các protein của virus vào các hạt cực nhỏ.
Nguồn: Time MagazineCông ty này đã nhận được khoản tài trợ lên tới 388 triệu đô la vào mùa xuân này từ Liên minh phòng chống các bệnh truyền nhiễm thời kì mới (CEPI), tài trợ cho việc phát triển vắc-xin COVID-19. Vắc xin được tạo ra bằng cách gắn các protein của virus vào các hạt cực nhỏ.
Vào tháng 8, Novavax đã tiến hành thử nghiệm giai đoạn 2 tại Nam Phi. Một tháng sau, công ty bắt đầu thử nghiệm giai đoạn 3 tại Vương quốc Anh. Nó có kế hoạch bắt đầu thử nghiệm giai đoạn 3 khác tại Hoa Kỳ vào cuối tháng 11.
Vào cuối tháng 1, các quan chức của công ty đã thông báo rằng vắc-xin của họ có hiệu quả tổng thể là 90% và hiệu quả 60% đối với biến thể Nam Phi.
Đại học Queensland tại Úc / CSL. Các nhà nghiên cứu tại trường đại học đã phát triển một loại vắc-xin bằng cách nuôi cấy các protein của virus trong các tế bào. Họ đã bắt đầu các giai đoạn thử nghiệm tiền lâm sàng vào đầu tháng Tư. Giai đoạn 1 thử nghiệm trên người đã bắt đầu vào đầu tháng Bảy. Giai đoạn 2/3 thử nghiệm dự kiến sẽ bắt đầu vào cuối năm nay.
Viện sản phẩm sinh học Vũ Hán / Sinopharm.
Công ty Trung Quốc Sinopharm đang thử nghiệm một loại vắc-xin vi rút bất hoạt do Viện Sản phẩm sinh học Vũ Hán phát triển. Sau khi thử nghiệm giai đoạn 1 thành công, các nhà nghiên cứu đã khởi động thử nghiệm giai đoạn 3 ở UAE vào tháng 7 và một tháng sau đó ở Peru và Morocco.
Viện Sản phẩm Sinh học Bắc Kinh / Sinopharm.
Sinopharm đang thử nghiệm loại vắc-xin vi rút bất hoạt thứ hai do Viện Sản phẩm sinh học Bắc Kinh phát triển.
Giai đoạn 3 thử nghiệm bắt đầu vào tháng 6 ở UAE và vào tháng 9 ở Argentina. Vào tháng 9, UAE đã phê duyệt vắc xin này để sử dụng cho các nhân viên y tế ngay cả trước khi có kết quả của thử nghiệm giai đoạn 3.
Công nghệ sinh học Sinovac.
Công ty Trung Quốc này đã tiến hành thử nghiệm giai đoạn 3 đối với vắc xin vi rút bất hoạt ở Brazil vào tháng 7, Indonesia vào tháng 8 và Thổ Nhĩ Kỳ vào tháng 9. Vào tháng 8, chính phủ Trung Quốc đã ban hành phê duyệt khẩn cấp vắc xin này để sử dụng cho các nhóm nguy cơ cao.
Bharat Biotech / Hội đồng nghiên cứu y tế Ấn Độ / Viện virus học quốc gia Ấn Độ. Vào cuối tháng 10, công ty Bharat của Ấn Độ đã thông báo rằng họ đang bắt đầu thử nghiệm giai đoạn 3 đối với vắc xin vi rút bất hoạt.
Vắc xin thay thế
Viện Nghiên cứu Trẻ em Murdoch ở Úc đang tiến hành thử nghiệm giai đoạn 3 đối với vắc xin phòng bệnh lao trực khuẩn Calmette-Guérin (BCG) để xem liệu nó có bảo vệ mọi người khỏi vi rút coronavirus hay không. Thử nghiệm này đang được tiến hành ở Úc, Brazil, Hà Lan, Tây Ban Nha và Vương quốc Anh.
Một số nhà khoa học cho rằng vắc xin chống bại liệt có thể tăng cường hệ thống miễn dịch vừa đủ để chống lại coronavirus mới, mặc dù vẫn chưa có bằng chứng xác nhận lý thuyết này.
Hai nhà nghiên cứu ở Hoa Kỳ cũng gợi ý rằng vắc-xin sởi, quai bị, rubella (MMR) có thể bảo vệ chống lại chứng viêm và nhiễm trùng huyết ở những người có COVID-19. Họ khuyên nên bắt đầu thử nghiệm lâm sàng với vắc xin MMR ở nhân viên y tế.
Thuốc chống vi-rút
Thuốc kháng vi-rút là loại thuốc được sử dụng để điều trị nhiễm vi-rút. Một số thuốc chống vi rút nhắm mục tiêu vào các vi rút cụ thể, trong khi những loại khác hoạt động chống lại một nhóm vi rút.
Những loại thuốc này có thể hoạt động theo nhiều cách khác nhau như ngăn không cho vi rút xâm nhập vào tế bào chủ, nhân lên và giải phóng vi rút làm lây nhiễm các tế bào khác.
Vào tháng 6 năm 2021, các quan chức Nhà Trắng thông báo họ sẽ chi 3 tỷ USD trong năm nay để phát triển thuốc kháng vi-rút để điều trị các triệu chứng COVID-19. Họ cho biết các loại thuốc mới có thể sẵn sàng vào cuối năm nay và có thể được sử dụng để điều trị các đại dịch virus khác trong tương lai.
Dưới đây là một số thuốc kháng vi-rút được dùng để điều trị COVID-19. Nhiều loại trong đó đã được chấp nhận điều trị bệnh khác hoặc thử nghiệm trên các loại virus khác.
Remdesivir (biệt dược Veklury).
Remdesivir đã thất bại trong các thử nghiệm lâm sàng chống lại Ebola vào năm 2014 nhưng được phát hiện là an toàn ở người.
Nghiên cứu cho thấy rằng loại thuốc này đã ngăn chặn virus corona nhân lên.
Vào tháng 4, nhà sản xuất thuốc Gilead Sciences thông báo một thử nghiệm remdesivir do Viện Dị ứng và Bệnh truyền nhiễm Quốc gia (NIAID) giám sát đã “đáp ứng tiêu chí chính ngăn chặn coronavirus”.
Dựa trên những kết quả này, FDA đã ban hành lệnh sử dụng khẩn cấp remdesivir cho bệnh nhân nhiễm COVID-19 nghiêm trọng khi nhập viện.
Vào tháng 8, EUA được cho phép sử dụng thuốc ở tất cả bệnh nhân COVID-19 nhập viện, bao gồm cả trẻ em.
Kết quả của một thử nghiệm giai đoạn 3 trên Tạp chí Y học New England cho thấy rằng remdesivir đã rút ngắn thời gian nằm viện của bệnh nhân COVID-19 khoảng 5 ngày.
Những người dùng remdesivir cũng có nguy cơ tử vong thấp hơn.
Vào ngày 22 tháng 10, FDA đã phê duyệt Remdesivir để sử dụng như một phương pháp điều trị COVID-19 ở người lớn và trẻ em từ 12 tuổi trở lên. Đây là thuốc đầu tiên được cơ quan phê duyệt như một phương pháp điều trị COVID-19.
Không phải tất cả các thử nghiệm lâm sàng đều phát hiện ra rằng remdesivir có hiệu quả.
Kết quả từ một thử nghiệm của Tổ chức Y tế Thế giới được công bố vào tháng 10 cho thấy rằng remdesivir ít ảnh hưởng đến thời gian mọi người ở lại bệnh viện và không ảnh hưởng đến nguy cơ tử vong của họ.
Vào giữa tháng 7, một nghiên cứu kết luận rằng remdesivir không mang lại lợi ích lâm sàng nào cho những người nhập viện với COVID-19 và có thể đã kéo dài thời gian nằm viện của họ.
AT-527.
Loại thuốc này được phát triển bởi Atea Pharmaceuticals công nghệ sinh học Boston và đang được phát triển với sự hợp tác của nhà sản xuất thuốc Roche.
Atea đã bắt đầu thử nghiệm giai đoạn 2 ở những người mắc COVID-19 nhập viện với triệu chứng ở mức độ trung bình và có kế hoạch thử nghiệm loại thuốc này vào năm tới, bên ngoài bệnh viện và thử xem liệu thuốc có thể hoạt động ở những người đã tiếp xúc với coronavirus gần đây hay không.
EIDD-2801.
Loại thuốc này được tạo ra bởi các nhà khoa học tại một công ty công nghệ sinh học phi lợi nhuận thuộc sở hữu của Đại học Emory.
Nghiên cứu trên chuột cho thấy nó có thể làm giảm sự sao chép của nhiều coronavirus, bao gồm cả SARS-CoV-2.
Công ty dược phẩm Merck và Ridgeback Biotherapeutics LP đã ký thỏa thuận để phát triển loại thuốc này. Một thử nghiệm giai đoạn 1 của loại thuốc này bắt đầu vào tháng 4,giai đoạn 2 vào tháng 7.
Không giống remdesivir, EIDD-2801 có thể được dùng bằng đường uống, điều này sẽ dễ dàng để tiếp cận với nhiều người hơn.
Favipiravir (biệt dược Avigan). Thuốc này được sản xuất bởi công ty Fujifilm Toyama Chemical Co., Ltd. của Nhật Bản, được phép sử dụng ở một số quốc gia bên ngoài Hoa Kỳ để điều trị bệnh cúm.
Nhật Bản đang gửi thuốc tới 43 quốc gia để thử nghiệm lâm sàng ở những người bị COVID-19 ở mức độ nhẹ hoặc trung bình.
Các nhà nghiên cứu Canada đang thử nghiệm để xem liệu loại thuốc này có thể giúp chống lại sự bùng phát trong các nơi chăm sóc dài hạn hay không.
Vào tháng 9, Fujifilm đã công bố kết quả của đợt thử nghiệm giai đoạn 3 bắt đầu vào tháng 3. Bệnh nhân COVID-19 dùng thuốc cải thiện trung bình sau 12 ngày so với hơn 14 ngày trung bình ở những người dùng giả dược không hoạt động.
Công ty đang tìm kiếm sự chấp thuận cho thuốc ở Nhật Bản như một phương pháp điều trị COVID-19.
Fluvoxamine.
Thuốc này đã được sử dụng để điều trị những người bị rối loạn ám ảnh / cưỡng chế. Vào giữa tháng 11, một nghiên cứu với 152 người tham gia báo cáo rằng thuốc có hiệu quả trong việc giảm bớt các triệu chứng của COVID-19.
Vào đầu tháng 2, một nghiên cứu chỉ ra fluvoxamine có thể giúp ngăn ngừa các triệu chứng COVID-19 nhẹ trở nên nặng hơn.
Kaletra.
Đây là sự kết hợp của hai loại thuốc - lopinavir và ritonavir - có tác dụng chống lại HIV.
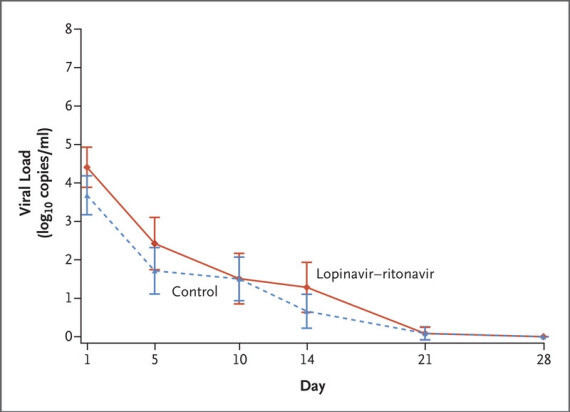 Nguồn: New England Journal of MedicineCác thử nghiệm lâm sàng đang được thực hiện để xem liệu kết hợp thuốc này có hoạt động chống lại SARS-CoV-2 hay không. Đã có nhiều kết quả khác nhau.
Nguồn: New England Journal of MedicineCác thử nghiệm lâm sàng đang được thực hiện để xem liệu kết hợp thuốc này có hoạt động chống lại SARS-CoV-2 hay không. Đã có nhiều kết quả khác nhau.Một nghiên cứu khác trên tạp chí Lancet cho thấy những người được dùng lopinavir / ritonavir cùng với hai loại thuốc khác - ribavirin và interferon beta-1b - mất ít thời gian hơn để loại bỏ vi rút khỏi cơ thể của họ.
Một nghiên cứu của Vương quốc Anh trên tạp chí The Lancet cho thấy kết hợp thuốc không làm giảm nguy cơ tử vong, thời gian nằm viện hoặc nhu cầu thở máy ở bệnh nhân COVID-19.
Merimepodib (VX-497).
Loại thuốc này, được phát triển bởi ViralClear Pharmaceuticals Inc., trước đây đã được chứng minh là có tác dụng kháng vi-rút và ức chế miễn dịch. Nó đã được thử nghiệm chống lại bệnh viêm gan C nhưng chỉ có tác dụng khiêm tốn.
Công ty đang chạy thử nghiệm giai đoạn 2 của loại thuốc này. Những người mắc COVID-19 nặng sẽ được nhận ngẫu nhiên merimepodib với remdesivir hoặc remdesivir cộng với giả dược.
Công ty đã kết thúc thử nghiệm giai đoạn 2 vào tháng 10 sau những lo ngại về tính an toàn của thuốc.
Niclosamide.
ANA Therapeutics đã bắt đầu thử nghiệm giai đoạn 2 và 3 vào tháng 10 đối với niclosamide dạng uống, một loại thuốc đã được sử dụng trong hơn 50 năm để điều trị sán dây, để xem liệu nó có giúp ích cho những người mắc bệnh COVID-19 hay không. Các nghiên cứu trước đó cho thấy loại thuốc này có hoạt tính kháng vi rút và điều hòa miễn dịch.
Umifenovir (biệt dược Arbidol). Thuốc kháng vi-rút này đã được thử nghiệm cùng với thuốc lopinavir / ritonavir để điều trị COVID-19.
Các nhà nghiên cứu đã báo cáo vào giữa tháng 4 rằng sự kết hợp ba loại thuốc không cải thiện kết quả lâm sàng cho những người nhập viện với các trường hợp COVID-19 từ nhẹ đến trung bình.
Một đánh giá vào tháng 7 của 12 nghiên cứu cho thấy Arbidol không cải thiện kết quả ở những người bị COVID-19.
Kháng thể đơn dòng
Các kháng thể đơn dòng kích hoạt hệ thống miễn dịch tấn công virus. Giống như các kháng thể do hệ thống miễn dịch của cơ thể tạo ra, các phân tử được tạo ra trong phòng thí nghiệm này nhắm mục tiêu đến một kẻ xâm lược cụ thể, chẳng hạn như SARS-CoV-2.
AstraZeneca đã nhận được tài trợ vào tháng 10 để bắt đầu thử nghiệm giai đoạn 3 đối với thuốc kết hợp kháng thể kháng SARS-CoV-2 AZD7442. Một nghiên cứu sẽ xem xét liệu thuốc có thể bảo vệ trong tối đa 12 tháng hay không.
Loại thuốc này được tạo ra từ hai loại kháng thể được phát hiện bởi Trung tâm Y tế Đại học Vanderbilt, được phân lập từ máu của một cặp vợ chồng đến từ Vũ Hán, Trung Quốc.
Celltrion.
Công ty Hàn Quốc này đã bắt đầu thử nghiệm giai đoạn 3 vào tháng 10 đối với phương pháp điều trị bằng kháng thể đơn dòng, CT-P59. Nó đang được thử nghiệm ở những người tiếp xúc gần với một người bị COVID-19 để xem liệu thuốc có thể ngăn ngừa lây nhiễm hay không.
Edesa Biotech Inc. đã nhận được sự chấp thuận để bắt đầu thử nghiệm giai đoạn 2 đối với loại thuốc kháng thể đơn dòng của mình, EB05. Công ty cho rằng thuốc của họ có thể làm giảm các phản ứng miễn dịch hoạt động quá mức liên quan đến hội chứng suy hô hấp cấp tính (ARDS).
Eli Lilly.
Vào đầu tháng 10, Eli Lilly đã báo cáo rằng một phương pháp điều trị mới liên quan đến hai kháng thể cho thấy kết quả đầy hứa hẹn trong việc giảm mức độ SARS-CoV-2. Phương pháp điều trị được thực hiện cho những người bị COVID-19 không phải nhập viện.
Kết quả đã được công bố trên Tạp chí Y học New England. Những người nhận được kháng thể đã giảm đáng kể mức độ vi rút sau 11 ngày. Họ cũng có các triệu chứng ít nghiêm trọng hơn một chút so với những người tham gia được dùng giả dược không hoạt động.
Vào giữa tháng 10, Viện Y tế Quốc gia đã tạm dừng thử nghiệm giai đoạn 3 đối với kháng thể của Eli Lilly do lo ngại về tính an toàn có thể xảy ra. Thuốc đang được thử nghiệm kết hợp với thuốc kháng vi-rút remdesivir.
Vào giữa tháng 11, thuốc Eli Lilly bamlanivimab đã nhận được Giấy phép sử dụng khẩn cấp từ FDA để sử dụng cho những người có các triệu chứng COVID-19 từ nhẹ đến trung bình có nguy cơ nhập viện hoặc các triệu chứng nghiêm trọng.
Vào giữa tháng 1, các nhà nghiên cứu đã báo cáo rằng bamlanivimab dùng cùng với etesevimab làm giảm tải lượng vi rút COVID-19 ở những người có các triệu chứng nhẹ hoặc trung bình.
Cũng vào giữa tháng 1, các quan chức Eli Lilly thông báo rằng bamlanivimab làm giảm đáng kể nguy cơ mắc bệnh COVID-19 có triệu chứng ở những người dân và nhân viên của viện dưỡng lão. Giai đoạn 3 thử nghiệm bao gồm 666 nhân viên và 299 cư dân.
Vào đầu tháng 3, các quan chức của công ty đã báo cáo rằng một thử nghiệm lâm sàng giai đoạn 3 cho thấy sự kết hợp thuốc giữa bamlanivimab và etesivmibab tạo ra nguy cơ nhập viện và tử vong do COVID-19 thấp hơn 87%.
Regeneron Pharmaceuticals Inc. đang thử nghiệm sự kết hợp hai loại kháng thể trong bốn nhóm: những người nhập viện với COVID-19; những người có các triệu chứng của bệnh nhưng không phải nhập viện; những người khỏe mạnh có nguy cơ cao mắc bệnh với COVID-19; và những người khỏe mạnh đã tiếp xúc gần với người mắc bệnh COVID-19.
Vào ngày 7 tháng 10, công ty đã yêu cầu FDA phê duyệt khẩn cấp hỗn hợp kháng thể của họ, hay còn gọi là “cocktail”. Thông báo được đưa ra vài ngày sau khi Tổng thống Trump được điều trị bằng thuốc COVID-19. Các quan chức của Regeneron cho biết ban đầu sẽ có sẵn liều cho 50.000 người.
Vào giữa tháng 10, công ty đã báo cáo rằng hỗn hợp kháng thể của họ đã hoạt động tốt trong một thử nghiệm lâm sàng liên quan đến chuột hamster và khỉ macaque rhesus.
Vào cuối tháng 10, công ty thông báo sẽ ngừng tuyển dụng những người tham gia cần bổ sung oxy ở mức độ cao vào thử nghiệm giai đoạn 2 và 3 do những lo ngại tiềm ẩn về an toàn. Những người cần lượng oxy bổ sung thấp hoặc không có sẽ tiếp tục được ghi danh.
Vào tháng 1 năm 2021, các quan chức của công ty đã thông báo rằng loại cocktail kháng thể của nó dường như có hiệu quả chống lại các biến thể của coronavirus mới ở Vương quốc Anh và Nam Phi.
Vào tháng 6 năm 2021, một nghiên cứu mới đã tiết lộ rằng sự kết hợp kháng thể Regeneron làm giảm nguy cơ tử vong đối với những người nhập viện với COVID-19, những người không tự hình thành hệ thống phòng vệ miễn dịch.
Trị liệu Sorrento. Công ty công nghệ sinh học nhỏ này đã thông báo vào tháng 5 rằng họ có một loại thuốc kháng thể có hiệu quả trong thử nghiệm sớm trong việc ngăn chặn SARS-CoV-2.
Công ty cho biết loại thuốc này có thể được sử dụng để điều trị những người mắc bệnh COVID-19 cũng như giúp ngăn ngừa nhiễm trùng.
Một nghiên cứu trước khi in được công bố vào tháng 9 cho thấy kháng thể bảo vệ chuột lang vàng Syria bị nhiễm SARS-CoV-2.
Công nghệ sinh học Vir đã phân lập được kháng thể từ những người sống sót sau SARS, một căn bệnh do một loại vi rút coronavirus khác gây ra. Công ty đang làm việc với công ty WuXi Biologics của Trung Quốc để thử nghiệm chúng như một phương pháp điều trị COVID-19.
Vào tháng 10, Vir và nhà sản xuất thuốc GlaxoSmithKline đã bắt đầu thử nghiệm giai đoạn 3 của liệu pháp kháng thể VIR-7831. Vào cuối tháng 5, FDA đã chấp thuận cấp giấy phép sử dụng khẩn cấp cho loại thuốc được gọi là sotrovimab.
Vào đầu tháng 11, Reuters đưa tin rằng một kế hoạch quy mô lớn của Tổ chức Y tế Thế giới nhằm cung cấp thuốc COVID-19 cho các nước nghèo hơn sẽ tập trung vào các phương pháp điều trị bằng kháng thể và steroid nhưng không bao gồm remdesivir.
Liệu pháp hồi phục bằng huyết tương
 Nguồn: B Medical System
Nguồn: B Medical SystemCùng quan điểm, FDA đã công bố một quy trình để các cơ sở y tế tiến hành thử nghiệm một phương pháp điều trị thử nghiệm sử dụng huyết tương từ những người đã khỏi bệnh sau COVID-19.
Lý thuyết là huyết tương của họ có chứa các kháng thể sẽ tấn công loại coronavirus đặc biệt này.
Vào cuối tháng 3, Trung tâm Máu ở New York đã bắt đầu thu thập huyết tương từ những người đã hồi phục sau COVID-19.
Vào cuối tháng 5, các nhà nghiên cứu báo cáo rằng 19 trong số 25 người mắc COVID-19 được điều trị bằng truyền huyết tương tại Bệnh viện Houston Methodist ở Texas đã cải thiện. Mười một bệnh nhân trong số đó đã được xuất viện.
Phòng khám Mayo và Đại học Bang Michigan cũng đang dẫn đầu các chương trình hồi phục bằng huyết tương.
Vào cuối tháng 8, FDA đã phê duyệt giấy phép sử dụng khẩn cấp cho liệu pháp ngẫu nhiên để điều trị COVID-19. Tuy nhiên, một số chuyên gia cho biết cần phải nghiên cứu thêm về loại điều trị này.
Một thử nghiệm giai đoạn 2 được công bố trên The BMJ vào tháng 10 cho thấy rằng phương pháp điều trị này không giúp gì cho việc tiến triển bệnh nặng hơn ở người bệnh COVID-19 hoặc giảm nguy cơ tử vong của họ.
Bộ điều biến miễn dịch
Ở một số người bị COVID-19, hệ thống miễn dịch hoạt động quá mức, giải phóng một lượng lớn các protein nhỏ gọi là cytokine.
Các nhà khoa học cho rằng “cơn bão cytokine” này có thể là lý do khiến một số người bị COVID-19 tiến triển hội chứng suy hô hấp cấp (ARDS) và cần sử dụng máy thở.
Một số thuốc ức chế miễn dịch đang được thử nghiệm trong các thử nghiệm lâm sàng để xem thuốc có thể làm giảm số lượng cytokine và giảm mức độ nghiêm trọng của ARDS hay không.
Dexamethasone.
Thuốc corticosteroid rẻ tiền đã được chấp thuận cho các bệnh lý khác và có thể được dùng bằng đường uống hoặc tiêm tĩnh mạch.
Kết quả sơ bộ được công bố vào tháng 7 trên Tạp chí Y học New England cho thấy liều lượng vừa phải của dexamethasone làm giảm tử vong ở những người nhập viện với COVID-19 trên máy thở và những người được bổ sung oxy nhưng không được thở bằng máy thở.
Các loại thuốc khác đang được thử nghiệm bao gồm baricitinib, một loại thuốc điều trị viêm khớp dạng thấp và chất ức chế IL-6.
Eli Lilly đã công bố vào tháng 10 rằng baricitinib kết hợp với remdesivir làm giảm thời gian hồi phục và cải thiện kết quả lâm sàng ở những người bị COVID-19. Những lợi ích lớn nhất được thấy ở những người được bổ sung oxy hoặc thông khí không xâm lấn.
Vào tháng 10, Viện Y tế Quốc gia đã bắt đầu thử nghiệm giai đoạn 3 của ba chất điều biến miễn dịch: infliximab, được phát triển bởi Johnson & Johnson; abatacept, được phát triển bởi Bristol Myers Squibb; và cenicriviroc, được phát triển bởi AbbVie.
FDA cũng đã phê duyệt cho một thiết bị lọc cytokines ra khỏi máu của những người mắc COVID-19.
Tế bào gốc
Athersys Inc. đã bắt đầu thử nghiệm giai đoạn 2 và 3 để xem xét liệu phương pháp điều trị bằng tế bào gốc của công ty có thể mang lại lợi ích cho những người mắc ARDS hay không.
Mesoblast cũng đã phát triển một phương pháp điều trị tế bào gốc tiềm năng cho ARDS. Công ty đang đăng ký những người mắc ARDS từ trung bình đến nặng vào thử nghiệm lâm sàng giai đoạn 2 và 3 tại Hoa Kỳ. Tính đến tháng 10, công ty đã ghi danh hơn một nửa số người tham gia thử nghiệm giai đoạn 3.
Các phương pháp điều trị khác
Các nhà khoa học cũng đang xem xét các cách khác để nhắm mục tiêu vi rút hoặc điều trị các biến chứng của COVID-19.
“Cocktail” kháng thể.
Vào cuối tháng 7, các nhà nghiên cứu tại Đại học Columbia ở New York đã công bố một số thành công ban đầu trong việc sử dụng hỗn hợp các kháng thể để có khả năng điều trị những người bị nhiễm SARS-CoV-2.
Họ cho biết các kháng thể được thu thập từ những người nhập viện với COVID-19. Hỗn hợp thuốc đã được thử nghiệm trên tế bào người cũng như chuột đồng.
Nếu được chứng minh là an toàn và hiệu quả, các kháng thể sẽ được truyền qua máu cho những người mới nhiễm vi rút.
Apilimod.
Vào cuối tháng 7, Đại học Yale thông báo họ đang tiến hành một cuộc thử nghiệm với AI Therapeutics trên một loại thuốc được gọi là apilimod.
Các quan chức của Yale cho biết loại thuốc này đã được chứng minh là an toàn trong điều trị các bệnh tự miễn và ung thư hạch dạng nang.
Họ cho biết nghiên cứu sơ bộ cho thấy apilimod có thể ngăn chặn sự xâm nhập tế bào của coronavirus mới.
Thuốc đã được FDA cấp chứng nhận lưu hành nhanh.
Thuốc viêm khớp.
Vào đầu tháng 1, các quan chức bệnh viện ở Vương quốc Anh báo cáo rằng tocilizumab và sarilumab, những loại thuốc được sử dụng để điều trị viêm khớp, có thể giảm thời gian nằm viện 10 ngày.
Họ nói thêm rằng hai loại thuốc này có thể làm giảm 24% nguy cơ tử vong do COVID-19 đối với những người bị bệnh nặng.
Chất làm loãng máu.
Vào giữa tháng 9, các nhà nghiên cứu Hoa Kỳ thông báo họ đã bắt đầu hai thử nghiệm lâm sàng để xem xét khả năng sử dụng chất làm loãng máu để điều trị COVID-19.
Một thử nghiệm sẽ tập trung vào những người có COVID-19 đã nhập viện trong khi thử nghiệm kia sẽ tập trung vào những người có COVID-19 không phải nhập viện.
Vào giữa tháng 2, một nghiên cứu đã báo cáo rằng thuốc làm loãng máu được sử dụng như một phương pháp điều trị dự phòng cho những người trong vòng 24 giờ sau khi nhập viện vì COVID-19 đã làm giảm nguy cơ tử vong do căn bệnh này.
Thuốc cannabinoid ARDS-003. Vào giữa tháng 9, các quan chức tại Tetra Bio-Pharma có trụ sở tại Canada thông báo họ đã nhận được sự chấp thuận của FDA để bắt đầu thử nghiệm giai đoạn 1 một loại thuốc cannabinoid tổng hợp để điều trị COVID-19.
Các quan chức của công ty cho biết thuốc có thể bảo vệ chống lại ARDS, một tình trạng là nguyên nhân phổ biến nhất gây tử vong cho những người bị COVID-19 nghiêm trọng.
Thuốc điều trị bệnh tiểu đường
Vào cuối tháng 9, các nhà nghiên cứu báo cáo rằng thuốc tiểu đường sitagliptin làm giảm tử vong và cải thiện kết quả lâm sàng ở những người mắc bệnh tiểu đường loại 2 được sử dụng thuốc sau khi nhập viện vì COVID-19.
Các nhà nghiên cứu cho biết có thể sitagliptin cũng có thể giúp những điều trị cho bệnh nhân mắc COVID-19 mà không mắc bệnh tiểu đường loại 2.
Thuốc coronavirus cho mèo.
Vào đầu tháng 9, một nghiên cứu báo cáo rằng một loại thuốc đôi khi được sử dụng để điều trị bệnh do coronavirus ở mèo đã cho thấy nhiều hứa hẹn trong một thử nghiệm chống lại COVID-19 ở người.
Loại thuốc này chưa được FDA chấp thuận để sử dụng cho mèo hoặc người, nhưng các nhà nghiên cứu cho biết nó đã cho thấy những dấu hiệu cho thấy nó có thể ngăn SARS-CoV-2 tái tạo bằng cách nhắm mục tiêu vào một phần quan trọng của bộ máy tế bào của vi rút.
Thuốc chữa bệnh gút.
Một nghiên cứu được công bố vào đầu tháng 2 báo cáo rằng colchicine, một loại thuốc được sử dụng để điều trị bệnh gút, làm giảm nhu cầu bổ sung oxy cũng như tăng tốc độ phục hồi cho những người nhập viện với COVID-19.
Các nhà nghiên cứu cho biết những người được điều trị bằng colchicine cần thở oxy ít hơn 3 ngày so với trung bình. Trung bình họ cũng phải nằm viện ít hơn hai ngày.
Ibuprofen.
Vào đầu tháng 6, các nhà khoa học đã bắt đầu thử nghiệm lâm sàng để xem liệu loại thuốc giảm đau có thể được sử dụng cho những người nhập viện với COVID-19 hay không.
Lý thuyết của họ là chất chống viêm của ibuprofen có thể giúp giảm bớt triệu chứng khó thở liên quan đến bệnh.
Interferon beta.
Vào giữa tháng 7, các nhà khoa học ở Vương quốc Anh đã báo cáo thành công trong các thử nghiệm ban đầu với một loại protein có tên là interferon beta. Cơ thể sản xuất protein này trong quá trình nhiễm virus.
Các nhà nghiên cứu cho biết protein này được hít trực tiếp vào phổi của người bệnh nhiễm SARS-CoV-2 với hy vọng kích thích phản ứng miễn dịch.
Họ cho biết protein này làm giảm 79% khả năng tiến triển một dạng bệnh nghiêm trọng ở những bệnh nhân nhập viện.
Kết quả sơ bộ từ một nghiên cứu của Tổ chức Y tế Thế giới cho thấy interferon beta không giúp ích cho những người mắc COVID-19.
Molnupiravir.
Thuốc này, được sản xuất bởi Merck, là một chất kháng vi-rút đường uống. Vào đầu tháng 3, kết quả từ thử nghiệm lâm sàng giai đoạn 2a cho thấy thuốc có thể làm giảm thời gian mắc bệnh do nhiễm COVID-19.
Thuốc xịt mũi.
Vào cuối tháng 9, các quan chức tại công ty công nghệ sinh học Úc Ena Respiratory đã báo cáo rằng một loại thuốc xịt mũi dùng để điều trị cảm lạnh và cúm có hiệu quả cao trong một nghiên cứu trên động vật trong việc giảm sự nhân lên của SARS-CoV-2. Các thử nghiệm trên người dự kiến sẽ sớm bắt đầu.
Oxit nitric.
Vào tháng 10, Nitric Oxide Innovations (NOI) LLC đã công bố kế hoạch bắt đầu nghiên cứu lâm sàng ngoại trú giai đoạn 2B và 3A về NOviricid, một loại viên ngậm kích thích sản xuất nitric oxide trong cơ thể.
Nghiên cứu sẽ thu nhận người Mỹ gốc Phi, một nhóm đã bị ảnh hưởng không đáng kể bởi COVID-19.
Nghiên cứu trước đó đã gợi ý rằng oxit nitric có thể hoạt động như một phương pháp điều trị COVID-19 bằng cách cải thiện chức năng mạch máu. Nó cũng có thể ngăn một số loại vi rút tái tạo.
Kháng thể tổng hợp. Vào giữa tháng 8, các nhà khoa học tại Đại học California, San Francisco thông báo họ đã tạo ra các kháng thể tổng hợp có thể vô hiệu hóa loại coronavirus mới.
Hợp chất này vẫn còn phải trải qua các thử nghiệm lâm sàng, nhưng các nhà khoa học cho biết nó có thể được cung cấp trong vòng vài tháng dưới dạng xịt mũi hoặc dạng hít.
Hydroxychloroquine và chloroquine. Những loại thuốc này đã nhận được giấy phép sử dụng khẩn cấp từ FDA vào cuối tháng Ba.
Vào ngày 15 tháng 6, FDA đã thu hồi Giấy phép ủy quyền đó, trích dẫn các nghiên cứu chỉ ra hydroxychloroquine không giúp ích đáng kể cho những người mắc COVID-19 và có thể gây ra các nguy cơ sức khỏe nghiêm trọng.
FDA cho phép nhà sản xuất Novartis tặng khoảng 30 triệu liều hydroxychloroquine và 1 triệu liều chloroquine cho Kho dự trữ quốc gia chiến lược.
 Nguồn: France24
Nguồn: France24Hoa Kỳ hiện còn lại 63 triệu liều hydroxychloroquine và 2 triệu liều chloroquine trong kho dự trữ khẩn cấp.
Vào cuối tháng 9, các nhà nghiên cứu tại Đại học Pennsylvania đã báo cáo rằng hydroxychloroquine không còn hiệu quả hơn trong việc ngăn chặn sự co lại của coronavirus mới ở những người dùng thuốc thay vì những người không dùng thuốc.
Vào đầu tháng 3, một nhóm chuyên gia từ WHO đã tuyên bố rằng không nên sử dụng hydroxychloroquine để ngăn ngừa hoặc điều trị COVID-19.
Các giai đoạn thử nghiệm lâm sàng
- Giai đoạn 1. Thuốc được dùng cho một số ít người khỏe mạnh và người mắc bệnh để tìm ra tác dụng phụ và tìm ra liều lượng tốt nhất.
- Giai đoạn 2. Thuốc được đưa cho vài trăm người mắc bệnh, xem liệu nó có hoạt động hay không và liệu có bất kỳ tác dụng phụ nào gặp phải trong quá trình thử nghiệm ban đầu hay không.
- Giai đoạn 3. Trong cuộc thử nghiệm quy mô lớn này, thuốc được cấp cho vài trăm, thậm chí lên đến 3.000 người. Một nhóm người tương tự dùng giả dược hoặc hợp chất không hoạt động. Thử nghiệm thường được thực hiện ngẫu nhiên và có thể kéo dài từ 1 đến 4 năm. Giai đoạn này cung cấp bằng chứng tốt nhất về cách thuốc hoạt động và các tác dụng phụ phổ biến nhất.
- Giai đoạn 4. Thuốc được phép sử dụng phải tiếp tục theo dõi để đảm bảo không có tác dụng phụ nào khác, đặc biệt là những những tác dụng nghiêm trọng hoặc lâu dài
Xem thêm: