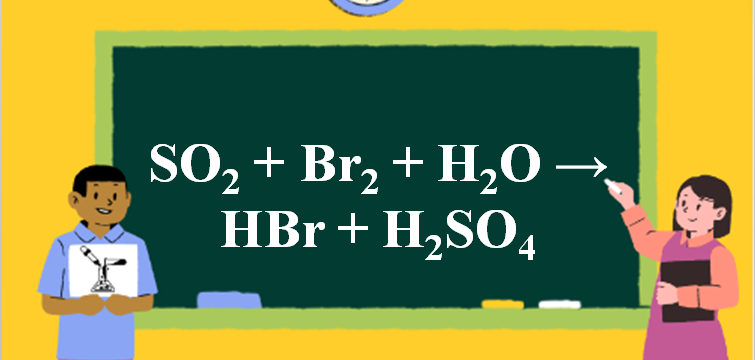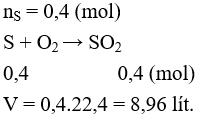Phản ứng SO2 + Br2 + H2O → HBr + H2SO4
1. Phương trình phản ứng SO2 ra HBr
SO2 + Br2 + 2H2O → 2HBr + H2SO4
2. Điều kiện phản ứng xảy ra SO2 và dung dịch Br2
Nhiệt độ thường
3. Cân bằng phản ứng SO2 + Br2+ H2O → H2SO4 + HBr bằng phương pháp thăng bằng electron
Bước 1. Xác định sự thay đổi số oxi hóa
S+4O2 + Br02 + H2O → 2HBr-1 + H2S+6O4
Bước 2: Lập thăng bằng electron
Quá trình nhường e
S+4 → S+ 6 + 2e
Quá trình nhận e
Br0 + 1e →Br-1
Đặt các hệ số tìm được vào phản ứng và tính các hệ số còn lại
SO2 + Br2+ 2H2O → 2HBr + H2SO4
4. Hiện tượng phản ứng xảy ra SO2 và Br2
Khi dẫn khí SO2 vào dung dịch Brom có màu vàng nâu nhạt, dung dịch Brom bị mất màu.
SO2 đã khử Br2 có màu thành HBr không màu.
5. Bản chất của các chất tham gia phản ứng
5.1. Bản chất của SO2 (Lưu huỳnh dioxit)
- Trong phản ứng trên SO2 là chất khử.
- SO2 làm mất màu nước Br2.
5.2. Bản chất của Br2 (Brom)
Trong phản ứng trên Br2 là chất oxi hoá.
6. Tính chất hoá học của SO2
* Lưu huỳnh đioxit tác dụng với nước:
SO2 + H2O ⇋ H2SO3
* Lưu huỳnh đioxit tác dụng với dung dịch bazơ (có thể tạo thành 2 loại muối sunfit và hiđrosunfit)
SO2 + NaOH → NaHSO3
SO2 + 2NaOH → Na2SO3 + H2O
* Lưu huỳnh đioxit tác dụng với oxit bazơ → muối:
SO2 + CaO → CaSO3
SO2 vừa là chất khử, vừa là chất oxi hóa (do S trong SO2 có mức oxi hóa trung gian +4)
* Lưu huỳnh đioxit là chất oxi hóa:
SO2 + 2H2S → 3S + 2H2O
Lưu huỳnh đioxit là chất khử
7. Tính chất hóa học của Br2
7.1. Tác dụng với kim loại
Sản phẩm tạo muối tương ứng
7.2. Tác dụng với hidro
- Độ hoạt động giảm dần từ Cl → Br → I
- Các khí HBr, HI tan vào nước tạo dung dịch axit.
- Về độ mạnh axit thì lại tăng dần từ HCl < HBr < HI.
7.3. Tính khử của Br2, HBr
- Brom thể hiện tính khử khi gặp chất oxi hóa mạnh (như nước clo, …)
Br2 + 5Cl2 + 6H2O → 2HBrO3 (Axit bromic) + 10HCl
- Tính khử của HBr (ở trạng thái khí cũng như trong dd) mạnh hơn HCl. HBr khử được H2SO4 đặc thành SO2.
2HBr + H2SO4đ → Br2 + SO2 + 2H2O
- Dd HBr không màu, để lâu trong không khí trở nên có màu vàng nâu vì bị oxi hóa (dd HF và HCl không có phản ứng này):
4HBr + O2 → 2H2O + 2Br2
8. Bài tập vận dụng
Câu 1. Sục một lượng khí SO2 vào dung dịch Ba(OH)2, thu được dung dịch B kết tủa C. Đun nóng dung dịch B lại thấy xuất hiện kết tủa. Dung dịch B tác dụng với Ba(OH)2 sinh ra được kết tủa. Thành phần của dung dịch B là:
A. BaSO3 và Ba(OH)2 dư
B. Ba(HSO3)2
C. Ba(OH)2
D. BaHSO3 và Ba(HSO3)2
Lời giải:
Đáp án: B
SO2 + Ba(OH)2 → BaSO3 ↓ + H2O
2SO2 + Ba(OH)2 → Ba(HSO3)2
Ba(HSO3)2 to→BaSO3↓ + SO2 + H2O
Ba(HSO3)2 + Ba(OH)2 → 2BaSO3↓ + 2H2O
Câu 2. Cho V lít SO2 (đktc) tác dụng hết với dung dịch Br2 dư. Thêm tiếp vào dung dịch sau phản ứng BaCl2 dư thu được 2,33 gam kết tủa. Thể tích V là:
A. 0,112 lít
B. 1,12 lít
C. 0,224 lít
D. 2,24 lít
Lời giải:
Đáp án: C
nBaSO4=0,01mol→nSO2=0,01mol
→VSO2=0,224(l)
Câu 3. Hấp thụ hoàn toàn 1,12 lít khí SO2 (đktc) vào 150 ml dung dịch NaOH 1M. Cô cạn dung dịch thu được
A. hỗn hợp hai muối NaHSO3, Na2SO3 và NaOH dư
B. Hỗn hợp 2 chất NaOH, Na2SO3
C. Hỗn hợp hai chất SO2 dư, NaOH
D. Hỗn hợp hai muối NaHSO3, Na2SO3
Lời giải:
Đáp án: B
nSO2= 0,05 mol,n NaOH = 0,15 mol
VìnNaOHnSO2=0,150,05=3> 2→ chỉ tạo 1 muối là Na2SO3
SO2 + 2 NaOH → Na2SO3 + H2O
0,05 0,15 → 0,05
→ NaOH dư sau phản ứng
→ Dung dịch chứa 2 chất NaOH, Na2SO3
Câu 4. Cho các phản ứng sau:
a) 2SO2 + O2 2SO3
b) SO2 + 2H2S 3S + 2H2O
c) SO2 + Br2 + 2H2O → H2SO4 + 2HBr
d) SO2 + NaOH → NaHSO3
Các phản ứng mà SO2 có tính khử là:
A. a, c, d
B. a,b,d
C. a,c
D. a,d
Lời giải:
Đáp án: C
a/ 2SO2 + O2 2SO3
c/ SO2 + Br2 + 2H2O → H2SO4 + 2HBr
Trong hai phản ứng a và c, số oxi hóa của S trong SO2 tăng từ +4 lên +6 do đó SO2 thể hiện tính khử.
Câu 5. Hóa chất dùng để phân biệt CO2 và SO2 là
A. nước brom
B. Bari hiđroxit
C. phenolphtalein
D. dung dịch nước vôi trong.
Lời giải:
Đáp án: A
SO2 làm mất màu nước brom còn CO2 thì không
SO2 + Br2+ 2 H2O → 2 HBr + H2SO4
Câu 6. Khí sunfurơ là chất có:
A. Tính khử mạnh.
B. Tính oxi hóa mạnh.
C. Vùa có tính oxi hóa vừa có tính khử.
D. Tính oxi hóa yếu.
Lời giải:
Đáp án: C
Khí sunfurơ là SO2.
Trong SO2, lưu huỳnh có số oxi hóa +4 là số oxi hóa trung gian nên SO2 vừa có tính oxi hóa và tính khử.
Câu 7. SO2 luôn thể hiện tính khử trong các phản ứng với
A. H2S, nước Br2, O2
B. dung dịch NaOH, O2, dung dịch KMnO4
C. dung dịch KOH, CaO, nước Br2
D. O2, nước Br2, dung dịch KMnO4
Lời giải:
Đáp án: D
A- loại H2S vì H2S là chất có tính khử nên khi phản ứng với H2S thì SO2 thể hiện tính oxi hóa.
B- loại NaOH vì phản ứng giữa SO2 và NaOH không phải là phản ứng oxi hóa khử
C- loại KOH vì phản ứng giữa SO2 và KOH không phải là phản ứng oxi hóa khử
D- đúng
Các phản ứng là:
2SO2 + O2 2SO3
SO2 + Br2 + 2H2O → 2HBr + H2SO4
5SO2 + 2KMnO4 + 2H2O → K2SO4 + 2MnSO4 + 2H2SO4
Câu 8. Hấp thụ hoàn toàn 2,24 lít khí SO2 (đkc) vào 100 ml dung dịch NaOH 1,5M. Muối thu được gồm:
A. Na2SO4
B. NaHSO3
C. Na2SO3
D. NaHSO3 và Na2SO3
Lời giải:
Đáp án: D
Ta có:
Nên muối thu được gồm: NaHSO3 và Na2SO3
Câu 9. Đốt cháy hoàn toàn 8,96 lít H2S (đktc) trong oxi dư, rồi dẫn tất cả sản phẩm vào 50 ml dung dịch NaOH 25% (D= 1,28). Nồng độ % muối trong dung dịch là
A. 47, 92%
B. 42, 96%
C. 42,69%
D. 24,97%
Lời giải:
Đáp án: B
; nNaOH = = 0,4 mol
2H2S + 3O2 → 2SO2+ 2H2O
Ta thấy: Tạo muối axit: NaOH + SO2 →NaHSO3
Theo PTHH:
→ mdd sau= 50.1,28 + 0,4.64 + 0,4.18 = 96,8g
→
Câu 10. Thể tích dung dịch NaOH 2M tối thiểu để hấp thụ hết 5,6 lít khí SO2 (đkc) là:
A. 250 ml
B. 500 ml
C. 125 ml
D. 175 ml
Lời giải:
Đáp án: C
Vì NaOH tối thiểu cần dùng nên chỉ xảy ra phản ứng tạo NaHSO3 (tỉ lệ NaOH : SO2 =1:1)
NaOH + SO2 → NaHSO3
Vdd NaOH = 0,125 (lít) = 125 (ml)
Câu 11. Đốt cháy hoàn toàn 4,8 gam lưu huỳnh rồi cho sản phẩm cháy hấp thụ hoàn toàn vào 200 ml dung dịch Ba(OH)2 0,5M. Khối lượng kết tủa thu được là:
A. 10,85 gam
B. 16,725 gam
C. 21,7 gam
D. 32,55 gam
Lời giải:
Đáp án: A
nS = 0,15 (mol)
S + O2 SO2
Theo PTHH:
Ta có tỉ lệ:
→ Thu được 2 muối: BaSO3 và Ba(HSO3)2
SO2 + Ba(OH)2 → BaSO3 + H2O
x →x→x (mol)
2SO2 + Ba(OH)2 → Ba(HSO3)2
2y→y→ y (mol)
Ta có hệ phương trình:
Giải hệ phương trình
Vậy
Câu 12. Hòa tan 8,36g oleum vào nước được dung dịch Y, để trung hòa dung dịch Y cần 200 ml dung dịch NaOH 1M. Công thức phân tử của oleum:
A. H2SO4. nSO3
B. H2SO4.3SO3
C. H2SO4. 5SO3
D. H2SO4. 4SO3
Lời giải:
Đáp án: D
Gọi công thức phân tử của oleum là: H2SO4.nSO3
H2SO4.nSO3 + nH2O → (n+1) H2SO4 (1)
← 0,1 mol
Dung dịch Y là dung dịch H2SO4
H2SO4 + 2 NaOH → Na2SO4 + 2H2O (2)
0,1 mol ← 0,2 mol
→ n = 4 → CTPT của oleum: H2SO4.4SO3
Câu 13. Thể tích khí SO2 ở đktc thu được khi cho 12,8 gam S phản ứng hoàn toàn với O2 dư là
A. 22,4 lít.
B. 3,36 lít.
C. 4,48 lít.
D. 8,96 lít.
Lời giải:
Đáp án: D
Câu 14. Để chứng minh SO2 là một oxit axit, người ta cho SO2 phản ứng với chất nào sau đây?
A. Dung dịch brom.
B. Dung dịch kiềm.
C. Dung dịch KMnO4.
D. Dung dịch axit sunfuhiđric.
Lời giải:
Đáp án: B
SO2 + 2NaOH → Na2SO3 + H2O
Xem thêm các phương trình hóa học hay khác:
SO2 + NaOH → Na2SO3 + H2O l SO2 ra Na2SO3
SO2 + KMnO4 + H2O → MnSO4 + K2SO4 + H2SO4 | SO2 ra H2SO4
SO2 + H2S → S + H2O | SO2 ra S