Phản ứng Mg + HNO3 → Mg(NO3)2 + NH4NO3 + H2O
1. Phương trình phản ứng Mg + HNO3 ra NH4NO3
4Mg + 10HNO3 → 4Mg(NO3)2 + NH4NO3+ 3H2O
2. Cân bằng phản ứng Mg + HNO3 → Mg(NO3)2 + NH4NO3 + H2O
Mg0 + HN+5O3 → Mg+2(NO3)2 + N-3H4NO3 + H2O
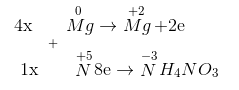
Tỉ lệ 2 muối nitrat của amoni và magiê là 1:4.
4Mg + 10HNO3 → 4Mg(NO3)2 + NH4NO3 + 3H2O
3. Điều kiện để phản ứng Mg tác dụng HNO3 loãng ra NH4NO3
Nhiệt độ thường
4. Bản chất của các chất tham gia phản ứng
4.1. Bản chất của Mg (Magie)
- Trong phản ứng trên Mg là chất khử.
- Mg là chất khử mạnh tác dụng được với các axit.
4.2. Bản chất của HNO3 (Axit nitric)
- Trong phản ứng trên HNO3 là chất oxi hoá.
- Đây là một monoaxit mạnh, có tính oxi hóa mạnh có thể nitrat hóa nhiều hợp chất vô cơ.
5. Tính chất hóa học của Mg
Magie là chất khử mạnh:
Mg → Mg2+ + 2e
5.1. Tác dụng với phi kim
Lưu ý:
Do Mg có ái lực lớn với oxi: 2Mg + CO2 → MgO. Vì vậy không dùng tuyết cacbonic để dập tắt đám cháy Mg.
5.2. Tác dụng với axit
- Với dung dịch HCl và H2SO4 loãng:
Mg + H2SO4 → MgSO4 + H2
- Với dung dịch HNO3:
4Mg + 10 HNO3 → 4 Mg(NO3)2 + NH4NO3 + 3 H2O
5.3. Tác dụng với nước
Ở nhiệt độ thường, Mg hầu như không tác dụng với nước. Mg phản ứng chậm với nước nóng (do tạo thành hidroxit khó tan).
Mg + 2H2O → Mg(OH)2 + H2
6. Bài tập vận dụng liên quan
Câu 1. Cho phương trình: Mg + HNO3 → Mg(NO3)2+ NH4NO3 + H2O
Tổng hệ số cân bằng tối giản của phản ứng trên là
A. 23
B. 24
C. 18
D. 22
Lời giải:
Câu 2. Cho Mg tan hoàn toàn trong dung dịch HNO3 loãng không thấy có khí thoát ra . Trong phương trình phản ứng tổng hệ số của các chất (nguyên, tối giản) là bao nhiêu?
A. 20
B. 24
C. 25
D. 22
Lời giải:
Câu 3. Cho 4,8 gam Mg tác dụng với dung dịch HNO3 dư. Sau khi phản ứng xảy ra hoàn toàn thu được 1,792 lít NO (đktc) và dung dịch X. Khối lượng muối khan thu được khi cô cạn dung dịch X là
A. 13,92 gam
B. 15,60 gam
C. 16,80 gam
D. 31,20 gam
Lời giải:
Ta có:
nMg = 0,2 mol
nNO = 0,08 mol
Các quá trình trao đổi electron
Mg0 → Mg+2 + 2e
0,2 → 0,4
N+5 + 3e→ N+2
0,24 ← 0,08
Vậy còn 1 sản phẩm khử nữa là NH4NO3
N+5 + 8e → N-3
8x → x
Áp dụng bảo toàn electron ta có:
0,4 = 0,24 + 8x → a = 0,02 mol
=> mmuối = mNH4NO3 + mMg(NO3)2 = 31,2 gam
Câu 4. Cho miếng Mg tác dụng với HNO3, sau phản ứng không thấy có khí sinh ra. Hệ số cân bằng của HNO3 trong phản ứng là
A. 8
B. 9
C. 10
D. 12
Lời giải:
Phản ứng không sinh ra khí => sản phẩm khử là muối NH4NO3
4Mg + 10HNO3 → 4Mg(NO3)2+ NH4NO3+ 3H2O
Câu 5. Cho m gam Mg vào dung dịch HNO3 dư, sau phản ứng kết thúc thu được 0,1792 lít khí N2 (đktc) và dung dịch X chứa 6,67 m gam muối. Giá trị của m gần nhất với giá trị nào sau đây
A. 3,6 gam
B. 1,2 gam
C. 2,4gam
D. 4,8 gam
Lời giải:

Câu 6. Hòa tan hoàn toan m gam Mg trong dung dịch HNO3 dư thu được 2,24 lít khí NO (đktc – sản phẩm khử duy nhất của N+5 ). Giá trị của m là?
A. 4,8
B. 3,6
C. 2,4
D. 3,0
Lời giải:
Đáp án : B
3Mg+ 8HNO3→ 3 Mg (NO3)2+ 2NO+ 4H2O
0,15 0,1
→ m = 0,15. 24 = 3,6 gam
Xem thêm các phương trình hóa học khác:
Mg + H2SO4 → MgSO4 + H2 | Mg ra MgSO4
Mg + HNO3 → Mg(NO3)2 + N2O + H2O | Mg ra Mg(NO3)2
Mg + HNO3 → Mg(NO3)2 + NO2 + H2O | Mg ra Mg(NO3)2