Lý thuyết Hóa 11 Bài 17: Phenol
A. Lý thuyết
I. Khái niệm và cấu trúc
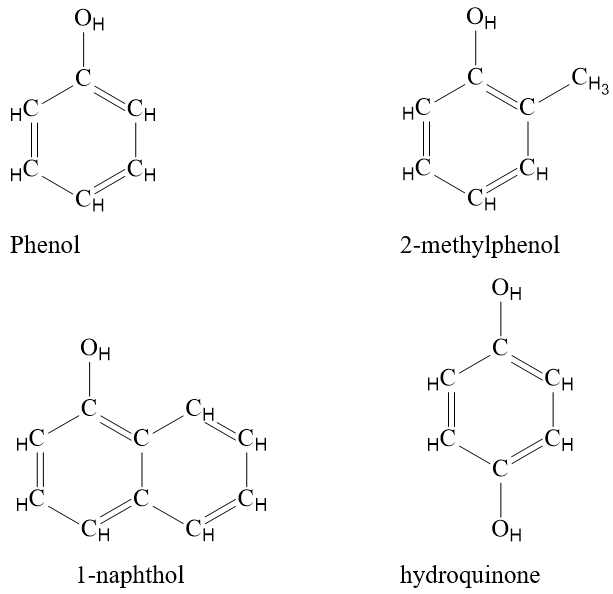
- Phenol là những hợp chất hữu cơ trong phân tử có nhóm –OH liên kết trực tiếp với nguyên tử carbon của vòng benzene.
- Phenol có nhóm phenyl hút electron, làm giảm mật độ electron ở nguyên tử oxygen, dẫn đến tăng sự phân cực của liên kết O – H (so với alcohol), đồng thời làm tăng mật độ electron trong vòng benzene, nhiều nhất ở các vị trí ortho và para.
II. Tính chất vật lí
- Phenol là chất rắn, không màu; phenol độc, gây bỏng cho da. Phenol ít tan trong nước lạnh, tan vô hạn trong nước ở 660C, tan tốt trong ethanol.
- Các phenol có nhiệt độ nóng chảy, nhiệt độ sôi cao hơn các hydrocarbon thơm có khối lượng phân tử tương đương.
III. Tính chất hoá học
1. Phản ứng thế nguyên tử hydrogen của nhóm OH: Tính acid
- Phenol thể hiện tính acid yếu, dung dịch phenol không làm quỳ tím đổi màu.
- Do nhóm phenyl hút electron, làm tăng sự phân cực của liên kết O – H, dẫn đến tính acid của phenol.
Ví dụ: C6H5OH + NaOH → C6H5ONa + H2
Sodium phenolate
C6H5OH + Na2CO3 ⇌ C6H5ONa + NaHCO3
Chú ý: Vì phenol gây ngộ độc qua đường miệng, gây bỏng cho da và mắt, nên phải sử dụng găng tay, kính bảo hộ khi tiến hành thí nghiệm.
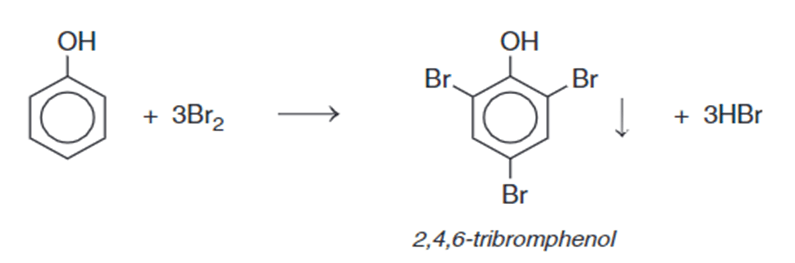
2. Phản ứng thế nguyên tử hydrogen của vòng benzene
Nhóm OH làm tăng khả năng phản ứng thế nguyên tử hydrogen trong vòng benzene của phenol (dễ thế nguyên tử hydrogen hơn so với benzene). Ưu tiên thế nguyên tử hydrogen ở các vị trí ortho (o-) và para (p-) của phenol.
IV. Ứng dụng và điều chế
- Phenol được sử dụng phổ biến trong lĩnh vực sản xuất như: chất sát trùng, diệt nấm, vi khuẩn, chất bảo quản, chất dẻo, chất kết dính, dược phẩm, phẩm nhuộm,…
- Phenol thường được điều chế từ cumene và được tách ra từ nhựa than đá.
B. Bài tập
Đang cập nhật......
Xem thêm các bài tóm tắt lý thuyết Hóa 11 Chân trời sáng tạo hay, chi tiết khác:
Lý thuyết Bài 14: Arene (Hydrocarbon thơm)
Lý thuyết Bài 15: Dẫn xuất halogen
Lý thuyết Bài 18: Hợp chất carbonyl
Lý thuyết Bài 19: Carboxylic acid