Câu hỏi:
05/01/2024 105
Cho các nguyên tố O (Z = 8), F (Z = 9), Si (Z = 14), S (Z = 16). Nguyên tố có tính phi kim lớn nhất trong số các nguyên tố trên là
Cho các nguyên tố O (Z = 8), F (Z = 9), Si (Z = 14), S (Z = 16). Nguyên tố có tính phi kim lớn nhất trong số các nguyên tố trên là
A. O.
B. F.
C. S.
D. Si.
Trả lời:
 Giải bởi Vietjack
Giải bởi Vietjack
Đáp án đúng là: B
Nhóm IVA
Nhóm VIA
Nhóm VIIA
Chu kì 2
O (Z = 8)
F (Z = 9)
Chu kì 3
Si (Z = 14)
S (Z = 16)
Theo quy luật biến đổi ta có tính phi kim: Si < S < O < F.
Vây nguyên tố có tính phi kim lớn nhất trong dãy là F.
Đáp án đúng là: B
|
|
Nhóm IVA |
Nhóm VIA |
Nhóm VIIA |
|
Chu kì 2 |
|
O (Z = 8) |
F (Z = 9) |
|
Chu kì 3 |
Si (Z = 14) |
S (Z = 16) |
|
Theo quy luật biến đổi ta có tính phi kim: Si < S < O < F.
Vây nguyên tố có tính phi kim lớn nhất trong dãy là F.
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Câu 3:
Liên kết trong phân tử nào sau đây được hình thành nhờ sự xen phủ orbital p-p ?
Câu 4:
Cho những nguyên tử của các nguyên tố sau:
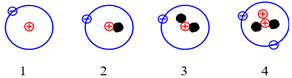
Những nguyên tử nào sau đây là đồng vị của nhau?
Câu 5:
Giải thích tại sao ở điều kiện thường, các nguyên tố nhóm halogen như fluorine và chlorine ở trạng thái khí, còn bromine ở trạng thái lỏng và iodine ở trạng thái rắn.
Câu 6:
Cho các hợp chất sau: Na2O; H2O; HCl; Cl2; O3; CH4. Có bao nhiêu chất mà trong phân tử chứa liên kết cộng hóa trị phân cực?
Cho các hợp chất sau: Na2O; H2O; HCl; Cl2; O3; CH4. Có bao nhiêu chất mà trong phân tử chứa liên kết cộng hóa trị phân cực?
Câu 7:
Cho các phát biểu sau
(a) Liên kết hydrogen yếu hơn liên kết ion và liên kết cộng hóa trị.
(b) Liên kết hydrogen mạnh hơn liên kết ion và liên kết cộng hóa trị.
(c) Tương tác van der Waals yếu hơn liên kết hydrogen.
(d) Tương tác van der Waals mạnh hơn liên kết hydrogen.
Phát biểu đúng là
Cho các phát biểu sau
(a) Liên kết hydrogen yếu hơn liên kết ion và liên kết cộng hóa trị.
(b) Liên kết hydrogen mạnh hơn liên kết ion và liên kết cộng hóa trị.
(c) Tương tác van der Waals yếu hơn liên kết hydrogen.
(d) Tương tác van der Waals mạnh hơn liên kết hydrogen.
Phát biểu đúng là
Câu 8:
Để lớp vỏ thỏa mãn quy tắc octet, nguyên tử oxygen (Z = 8) có xu hướng
Câu 9:
Trong các nhóm A, sự biến thiên tính chất của các nguyên tố thuộc chu kì sau lại lặp lại giống như chu kì trước (biến đổi tuần hoàn) là do
Câu 11:
Cấu hình electron ở lớp ngoài cùng của nguyên tử nguyên tố X là 3s23p5. Liên kết của nguyên tử này với nguyên tử hydrogen thuộc loại liên kết nào sau đây?
Câu 12:
Số lượng cặp electron dùng chung trong các phân tử O2, N2, F2 lần lượt là
Câu 13:
Viết cấu hình electron của các ion: K+, Mg2+, F–, S2–. Mỗi cấu hình đó giống với cấu hình electron của nguyên tử khí hiếm nào?
Viết cấu hình electron của các ion: K+, Mg2+, F–, S2–. Mỗi cấu hình đó giống với cấu hình electron của nguyên tử khí hiếm nào?
Câu 14:
Ở trạng thái cơ bản, nguyên tử aluminium (Al) có số electron độc thân là
Ở trạng thái cơ bản, nguyên tử aluminium (Al) có số electron độc thân là