Giải Khoa học tự nhiên 7 Bài 2: Nguyên tử
Video giải bài tập Khoa học tự nhiên 7 Bài 2: Nguyên tử
Trả lời:
Mỗi chất lại được tạo nên từ những hạt vô cùng nhỏ. Những hạt đó gọi là nguyên tử.
1. Mô hình nguyên tử Rutherford – Bohr
Trả lời:
Quan sát bằng mắt thường: Ruột bút chì
Quan sát bằng kính lúp: Hạt bụi trong không khí
Quan sát bằng kính hiển vi: Tế bào máu, vi khuẩn.
Trả lời:
Khí oxygen, sắt, than chì đều được tạo nên từ những hạt vô cùng nhỏ, gọi là nguyên tử.
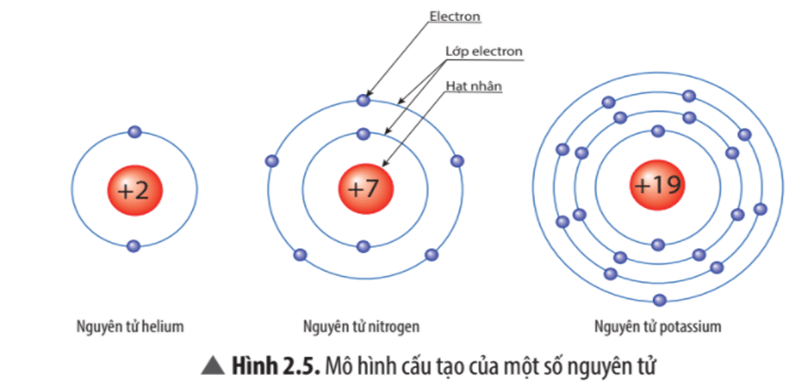
Câu hỏi thảo luận 3 trang 15 KHTN lớp 7: Theo Rutherford – Bohr, nguyên tử có cấu tạo như thế nào?
Trả lời:
Theo Rutherford – Bohr, nguyên tử có cấu tạo gồm hạt nhân ở bên trong và lớp vỏ tạo bởi một hay nhiều electron (kí hiệu là e) mang điện tích âm. Bên trong hạt nhân chứa các hạt proton (kí hiệu là p) mang điện tích dương.
Các electron được sắp xếp thành từng lớp và chuyển động xung quanh hạt nhân theo quỹ đạo tương tự như hành tinh trong hệ Mặt Trời.
a) điện tích hạt nhân nguyên tử?
Trả lời:
|
|
Nguyên tử nitrogen |
Nguyên tử potassium |
|
Điện tích hạt nhân nguyên tử |
+7 |
+19 |
|
Lớp electron |
2 |
4 |
|
Electron trên mỗi lớp |
2/5 |
2/8/8/1 |
Câu hỏi thảo luận 5 trang 16 KHTN lớp 7: Tại sao nguyên tử trung hòa về điện?
Trả lời:
Mỗi electron mang điện tích -1, mỗi proton mang điện tích +1, mà trong nguyên tử, số hạt proton và electron luôn bằng nhau do đó nguyên tử trung hòa về điện.
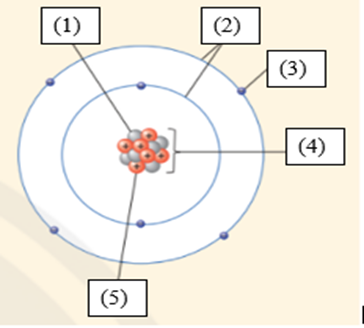
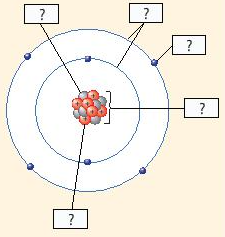
(1) Neutron
(2) Vỏ nguyên tử
(3) Electron
(4) Hạt nhân nguyên tử
(5) Proton
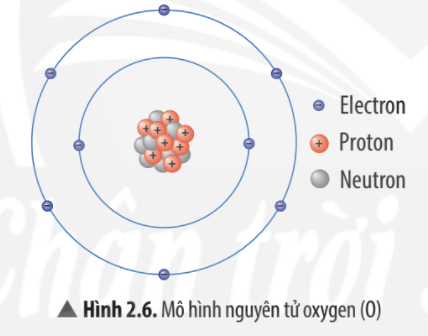
Luyện tập 2 trang 16 KHTN lớp 7: Quan sát Hình 2.6, hãy hoàn thành bảng sau:
Trả lời:
|
Số đơn vị điện tích hạt nhân |
Số proton |
Số electron trong nguyên tử |
Số electron ở lớp ngoài cùng |
|
8 |
8 |
8 |
6 |
Để lớp electron ngoài cùng của nguyên tử oxygen có đủ số electron tối đa là 8 thì cần thêm 2 electron nữa.
2. Khối lượng nguyên tử
Trả lời:
Khối lượng của nguyên tử rất nhỏ, không thể cân đo dễ dàng bằng các dụng cụ bình thường (theo khối lượng g hay kg), bên cạnh đó phải sử dụng số mũ, lũy thừa âm lớn cho các đơn vị g hay kg nên không thuận tiện.Vì thế để biểu thị khối lượng nguyên tử người ta sử dụng đơn vị khối lượng nguyên tử, viết tắt là amu (atomic mass unit).
1 amu = 1,6605 × 10-24 gam
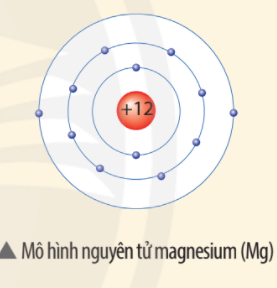
Trả lời:
Điện tích hạt nhân nguyên tử Mg là +12.
⇒ Một nguyên tử magnesium (Mg) gồm: 12 proton, 12 electron.
Khối lượng nguyên tử Mg bằng 12 + 12 = 24 amu.
(do khối lượng 1p = 1n = 1 amu).
Bài tập (trang 17)
|
|
Trong nguyên tử, các electron (8) … xung quanh hạt nhân và (9) … thành từng lớp.
Trả lời:
(1) vô cùng nhỏ
(2) trung hòa về điện
(3) hạt nhân
(4) điện tích dương
(5) vỏ nguyên tử
(6) các electron
(7) điện tích âm
(8) chuyển động
(9) sắp xếp
Bài 2 trang 17 KHTN lớp 7: Vì sao nói khối lượng hạt nhân được coi là khối lượng nguyên tử?
Trả lời:
Proton và neutron có khối lượng xấp xỉ bằng nhau (gần bằng 1 amu). Electron có khối lượng rất bé (chỉ khoảng bằng 0,00055 amu), nhỏ hơn rất nhiều lần so với khối lượng của proton và neutron. Do đó khối lượng hạt nhân được coi là khối lượng nguyên tử.
Xem thêm lời giải SGK Khoa học tự nhiên lớp 7 Chân trời sáng tạo hay, chi tiết khác:
Bài 1: Phương pháp và kĩ năng học tập môn Khoa học tự nhiên
Bài 4: Sơ lược bảng tuần hoàn các nguyên tố hóa học