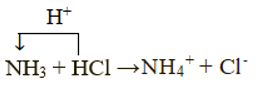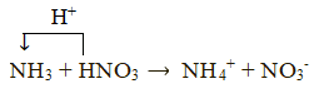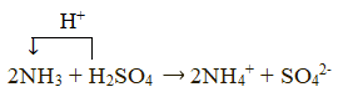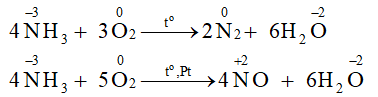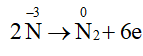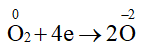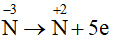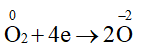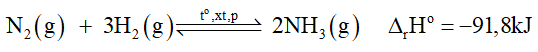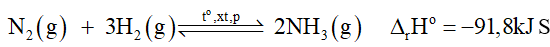Giải Hóa học 11 Bài 5: Ammonia. Muối ammonium
Lời giải:
Trong công nghiệp, phản ứng giữa ammonia với acid được dùng để sản xuất phân bón.
Ví dụ:
NH3 + HCl → NH4Cl
NH3 + HNO3 → NH4NO3
2NH3 + H2SO4 → (NH4)2SO4
Trong các phản ứng này ammonia đóng vai trò là base.
I. Ammonia
Hoạt động 1 trang 33 Hóa học 11: Viết cấu hình electron của các nguyên tử H (Z = 1) và N (Z = 7).
Lời giải:
Cấu hình electron nguyên tử H (Z = 1): 1s1.
Cấu hình electron nguyên tử N (Z = 7): 1s2 2s2 2p3.
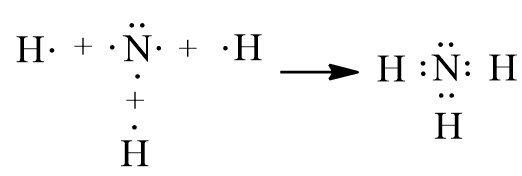
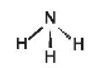
Hoạt động 2 trang 33 Hóa học 11: Trình bày các bước lập công thức Lewis của phân tử ammonia.
Lời giải:
Các bước lập công thức Lewis của phân tử ammonia (NH3):
Cách 1: Viết công thức Lewis dựa vào công thức electron
Bước 1: Viết công thức electron:
Bước 2: Từ công thức electron, thay 1 cặp electron dùng chung bằng 1 gạch nối giữa hai nguyên tử ta được công thức Lewis:
Cách 2: Thực hiện lần lượt theo các bước sau:
Bước 1: Tính tổng số electron hóa trị trong phân tử:
Nitrogen (N) có 5 electron hóa trị, hydrogen có 1 electron hóa trị. Trong phân tử NH3 có 1 nguyên tử N và 3 nguyên tử H. Vậy tổng số electron hóa trị = 5 + 3.1 = 8 electron
Bước 2: Vẽ khung phân tử tạo bởi liên kết đơn giữa các nguyên tử:
Trong phân tử NH3, nguyên tử N cần 3 electron để đạt octet, mỗi nguyên tử H cần 1 electron để đạt octet. Vì vậy, N là nguyên tử trung tâm, còn các nguyên tử H được xếp xung quanh:
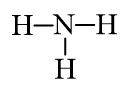
Bước 3: Tính số electron hóa trị chưa tham gia liên kết bằng cách lấy tổng số electron trừ số electron tham gia tạo liên kết:
Số electron hóa trị chưa tham gia liên kết trong sơ đồ là: 8 – 2.3 = 2 electron.
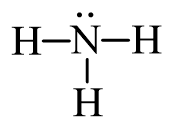
Bước 4: Hoàn thiện octet cho các nguyên tử có độ âm điện lớn hơn trong sơ đồ:
Từ công thức (1), nguyên tử H đã đủ octet, hoàn thiện octet cho N. Xung quanh nguyên tử N mới có 6 electron, ta bổ sung 2 electron vào nguyên tử N. Ta được công thức (2) chính là công thức Lewis của NH3:
Lời giải:
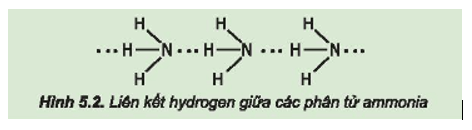
Trong phân tử nitrogen:
- Nguyên tử nitrogen còn một cặp electron không liên kết, tạo ra vùng có mật độ điện tích âm trên nguyên tử nitrogen.
- Liên kết N – H phân cực, cặp electron dùng chung lệch về phía nguyên tử nitrogen làm cho nguyên tử hydrogen mang một phần điện tích dương.
Do đó, các phân tử ammonia có khả năng tạo liên kết hydrogen mạnh với nhau.
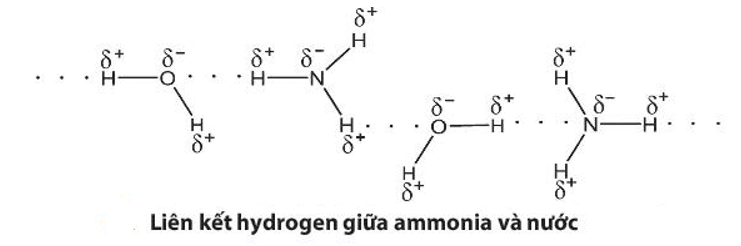
Câu hỏi 2 trang 34 Hóa học 11: : Hãy giải thích tại sao ammonia tan tốt trong nước
Lời giải:
Vì tạo được liên kết hydrogen với nước nên ammonia tan nhiều trong nước.
Hoạt động trang 34 Hóa học 11:
Trong công nghiệp, phản ứng giữa ammonia với acid được dùng để sản xuất phân bón:
NH3 + HCl → NH4Cl
NH3 + HNO3 → NH4NO3
2NH3 + H2SO4 → (NH4)2SO4
Xác định chất cho, chất nhận proton trong mỗi phản ứng trên. Dùng mũi tên để biểu diễn sự cho, nhận đó.
Lời giải:
Xét phản ứng: NH3 + HCl → NH4Cl
Chất cho proton là HCl, chất nhận proton là NH3:
Xét phản ứng: NH3 + HNO3 → NH4NO3
Chất cho proton là HNO3, chất nhận proton là NH3:
Xét phản ứng: 2NH3 + H2SO4 → (NH4)2SO4
Chất cho proton là H2SO4, chất nhận proton là NH3:
a) Xác định các nguyên tử có sự thay đổi số oxi hoá.
b) Viết quá trình oxi hoá, quá trình khử.
Lời giải:
a) Các nguyên tử có sự thay đổi số oxi hoá trong 2 phản ứng là nitrogen và oxygen.
b)
4NH3 + 3O2
2N2 + 6H2O
Quá trình oxi hoá:
Quá trình khử:
4NH3 + 5O2 
Quá trình oxi hoá:
Quá trình khử:
Lời giải:
Thuyết trình về ứng dụng của ammonia trong thực tiễn (tham khảo SGK Hoá học 10 – CD):
Gần đây, mỗi năm có khoảng hàng trăm triệu tấn ammonia được sản xuất trên toàn cầu. Trong đó, có khoảng 80% được sử dụng cho sản xuất phân đạm ammonium, urea ((NH2)2CO),... để cung cấp nguyên tố nitrogen cho đất và cây trồng. Các phân đạm ammonium được tổng hợp bằng cách cho ammonia phản ứng với dung dịch acid tương ứng. Chẳng hạn, phản ứng dưới đây dùng để tạo ra phân bón với thành phần chính là ammonium sulfate.
2NH3(aq) +H2SO4 (aq) → (NH4)2SO4 (aq)
Ammonia còn là nguyên liệu quan trọng để sản xuất nitric acid, sản xuất một số chất gây nổ sử dụng trong khai thác quặng mỏ như ammonium nitrate,...
Giống như nitrogen lỏng, ammonia lỏng cũng được sử dụng với vai trò chất làm lạnh trong một số hệ thống làm lạnh công nghiệp.
Ngoài ra, ammonia lỏng được sử dụng làm dung môi để hoà tan một số chất. Nhiều phản ứng cũng được thực hiện trong dung môi ammonia lỏng.
1. Nếu tăng hoặc giảm nhiệt độ sẽ ảnh hưởng đến sự chuyển dịch cân bằng và tốc độ phản ứng như thế nào?
2. Nếu giảm áp suất, cân bằng chuyển dịch theo chiều nào? Tại sao không thực hiện ở áp suất cao hơn?
3. Vai trò của chất xúc tác trong phản ứng là gì?
Lời giải:
Trong công nghiệp, quá trình sản xuất ammonia thường được thực hiện ở nhiệt độ 400 oC – 450 oC,áp suất 150 – 200 bar, xúc tác Fe.
1) Vì DrHo = -91,8 kJ < 0 nên phản ứng thuận toả nhiệt. Vậy:
+ Nếu tăng nhiệt độ, cân bằng chuyển dịch theo chiều nghịch (tức chiều phản ứng thu nhiệt) làm giảm hiệu suất phản ứng.
+ Nếu giảm nhiệt độ, cân bằng chuyển dịch theo chiều thuận (tức chiều phản ứng toả nhiệt) làm tăng hiệu suất phản ứng.
Tuy nhiên, khi thực hiện phản ứng ở nhiệt độ quá thấp thì tốc độ của phản ứng nhỏ, phản ứng diễn ra chậm. Thực tế, người ta đã chọn nhiệt độ phù hợp, khoảng 400 oC - 450 oC.
2. Khi giảm áp suất, cân bằng chuyển dịch theo chiều làm tăng áp suất của hệ - tức chiều làm tăng số mol khí, hay chiều nghịch.
Quá trình sản xuất NH3 được thực hiện ở áp suất 150 – 200 bar mà không thực hiện ở áp suất cao hơn. Điều này được giải thích như sau: Khi thực hiện ở áp suất cao sẽ thu
được nồng độ NH3 tại thời điểm cân bằng lớn, tuy nhiên khi tăng áp suất thì
sự tăng nồng độ NH3 không tăng nhanh chỉ tăng chậm. Ngoài ra, khi tăng áp suất thì
tiêu tốn năng lượng và yêu cầu thiết bị phải chịu được áp suất cao, do đó phải
tính toán chính xác khi tăng áp suất để mang lại hiệu quả kinh tế cao nhất. Thực tế chứng minh quá trình sản xuất NH3 được thực hiện ở áp suất 150 – 200 bar đem lại hiệu quả cao nhất.
3. Việc sử dụng chất xúc tác là bột sắt có tác dụng làm cho phản ứng nhanh đạt tới trạng thái cân bằng.
II. Muối ammonium
Thí nghiệm trang 36 Hóa học 11: Nhận biết ion ammonium trong phân đạm
Chuẩn bị: phân bón potassium nitrate và phân bón ammonium chloride dạng rắn, dung dịch NaOH 20%, giấy pH; bình xịt tia nước cất, 2 ống nghiệm, kẹp gỗ, đèn cồn.
Tiến hành:
– Cho khoảng 1 g phân bón potassium nitrate vào ống nghiệm (1) và khoảng 1 g phân bón ammonium chloride vào ống nghiệm (2).
– Thêm vào mỗi ống nghiệm khoảng 3 mL nước cất, lắc đều cho tan hết.
– Nhỏ 1 mL dung dịch NaOH 20% vào mỗi ống nghiệm, đun nóng nhẹ trên đèn cồn.
– Đưa hai mẩu giấy pH đã tẩm ướt vào miệng mỗi ống nghiệm.
Quan sát hiện tượng và trả lời câu hỏi:
Dựa vào dấu hiệu nào để nhận biết ion ammonium? Giải thích bằng phương trình hoá học.
Lời giải:
- Hiện tượng:
+ Hai mẫu phân bón đều dễ tan trong nước.
+ Đun nhẹ hai ống nghiệm đều thấy thoát ra khí không màu, có mùi khai và xốc.
+ So sánh màu ở mẩu giấy pH với thang pH thấy tạo thành môi trường base.
- Dấu hiệu để nhận biết ion ammonium: Khi đun nóng hỗn hợp muối ammonium với dung dịch kiềm sinh ra khí ammonia có mùi khai.
Phương trình hoá học:
NH4NO3 + NaOH 
NH4Cl + NaOH 
b) Viết phương trình hoá học minh hoạ tính acid/base của ammonia và ammonium.
Lời giải:
a)
|
Phân tử/ Ion |
Dạng hình học |
Số liên kết cộng hoá trị của nitrogen |
Số oxi hoá của nitrogen |
|
Ammonia (NH3) |
Chóp tam giác |
3 |
-3 |
|
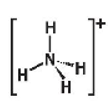
Ammonium (NH4+) |
Tứ diện |
4 |
-3 |
b)
- NH3 có tính base. Một số phương trình hoá học minh hoạ:
NH3 + HCl → NH4Cl
2NH3 + H2SO4 → (NH4)2SO4.
- NH4+ có tính acid. Một số phương trình hoá học minh hoạ:
NH4NO3 + NaOH 
NH4Cl + NaOH 
Phương trình ion rút gọn:
NH4+ + OH− → NH3 + H2O.
- Nhận biết được ion ammonium trong phân đạm.
Lời giải:
- Trong công nghiệp, quá trình sản xuất ammonia thường được thực hiện ở nhiệt độ 400 oC – 450 oC, áp suất 150 – 200 bar, xúc tác Fe.
+ Về áp suất: người ta đã tăng áp suất của hệ phản ứng trong buồng tổng hợp lên đến gần 200 bar. Đó là do khi tăng áp suất, cân bằng chuyển dịch theo chiều làm giảm áp suất của hệ - tức chiều giảm số mol khí, hay chiều tạo ammonia (chiều thuận).
+ Về nhiệt độ: Vì phản ứng thuận toả nhiệt (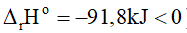
+ Việc sử dụng xúc tác là bột sắt trong quá trình Haber có tác dụng làm cho phản ứng nhanh đạt tới trạng thái cân bằng.
- Nhận biết ion ammonium trong phân đạm: Khi đun nóng hỗn hợp phân đạm chứa muối ammonium với dung dịch kiềm sinh ra khí ammonia có mùi khai.
Phương trình hoá học minh hoạ:
NH4NO3 + NaOH 
NH4Cl + NaOH 
Xem thêm các bài giải SGK Hoá học 11 Kết nối tri thức hay, chi tiết khác:
Bài 6: Một số hợp chất của nitrogen với oxygen