Giải Hoá Học 10 Bài 3: Nguyên tố hóa học
Lời giải:
- Nguyên tố hóa học là tập hợp những nguyên tử có cùng điện tích hạt nhân.
- Số đơn vị điện tích hạt nhân nguyên tử (còn gọi là số hiệu nguyên tử) của một nguyên tố hóa học và số khối được xem là những đặc trưng cơ bản của nguyên tử.
1. Hạt nhân nguyên tử
Lời giải:
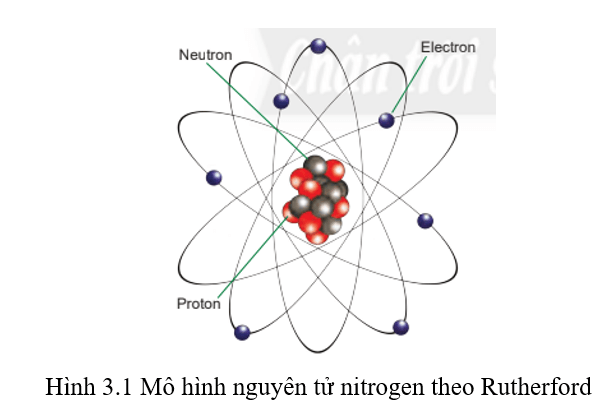
Dựa vào mô hình ta thấy: Nguyên tử nitrogen có 7 proton, 7 neutron và 7 electron.
Câu hỏi 2 trang 20 Hóa học 10: Điện tích hạt nhân của nguyên tử nitrogen có giá trị là bao nhiêu?
Lời giải:
Nguyên tử nitrogen có số đơn vị điện tích hạt nhân Z = số proton = 7.
⇒ Điện tích hạt nhân của nguyên tử nitrogen bằng +Z = +7.
Lời giải:
Nguyên tử nitrogen có số đơn vị điện tích hạt nhân (Z) = số proton = số electron = 11.
Câu hỏi 3 trang 21 Hóa học 10: Bổ sung những dữ liệu còn thiếu trong bảng 3.1.
Lời giải:
Số khối (A) = số proton (P) + số neutron (N)
Số proton (P) = số electron (E)
|
Tên nguyên tố |
Kí hiệu |
P |
N |
Số khối (A) |
E |
|
Helium |
He |
2 |
2 |
4 |
2 |
|
Lithium |
Li |
3 |
4 |
7 |
3 |
|
Nitrogen |
N |
7 |
7 |
14 |
7 |
|
Oxygen |
O |
8 |
8 |
16 |
8 |
2. Nguyên tố hóa học
Lời giải:
Điện tích hạt nhân của carbon là +6.
Lời giải:
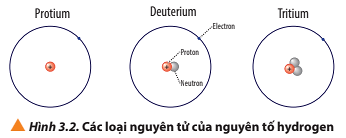
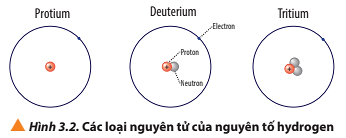
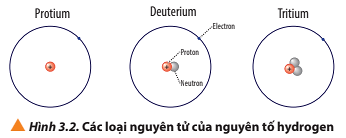
Protium: 1 proton, 0 neutron, 1 electron, điện tích hạt nhân nguyên tử là +1
Deuterium: 1 proton, 1 neutron và 1 electron, điện tích hạt nhân nguyên tử là +1
Tritium: 1 proton, 2 neutron và 1 electron, điện tích hạt nhân nguyên tử là +1
Câu hỏi 6 trang 22 Hóa học 10: Kí hiệu nguyên tử cho biết những thông tin nào?
Lời giải:
Kí hiệu nguyên tử cho biết:
- Kí hiệu nguyên tố hóa học
- Số khối
- Số hiệu nguyên tử
Ví dụ:
Luyện tập trang 22 Hóa học 10: a) Viết kí hiệu các nguyên tử của nguyên tố hydrogen (Hình 3.2).
Lời giải:
a)
- Nguyên tử protium: 1 proton, 0 neutron ⇒ Z = 1, A = 1
⇒ Kí hiệu:
- Nguyên tử deuterium: 1 proton, 1 neutron ⇒ Z = 1, A = 2
⇒ Kí hiệu:
- Nguyên tử tritium: 1 proton, 2 neutron ⇒ Z = 1, A = 3
⇒ Kí hiệu:
b)
- Nguyên tử oxygen có 8 electron
⇒ Số E = Số P = Z = 8
- Nguyên tử oxygen có 8 neutron
⇒ Số khối A = P + N = 8 + 8 = 16
⇒ Kí hiệu nguyên tử:
3. Đồng vị
Lời giải:
Giống nhau: đều có 1 proton và 1 electron
Khác nhau: số lượng hạt neutron khác nhau
Lời giải:
- Carbon có 6 proton ⇒ Số hiệu nguyên tử Z = 6
- Kí hiệu nguyên tử carbon có số khối bằng 12 là:
- Kí hiệu nguyên tử carbon có số khối bằng 13 là:
4. Nguyên tử khối và nguyên tử khối trung bình
Lời giải:
⇒ Nguyên tử khối của Mg = số khối = số proton + số neutron = 24 (amu)
Lời giải:
Nguyên tử khối trung bình của nguyên tố copper:
Lời giải:
Tỉ lệ hai đồng vị (98,98%) và (1,11%) trong testosterone tự nhiên trong cơ thể là
Đối với kết quả mẫu phân tích ta có:
⇒ > 89, 171
⇒ Từ kết quả thu được, em nghi ngờ vận động viên này đã có sử dụng doping.
Bài tập (trang 25)
Lời giải:
Đáp án: C
- Nguyên tử X có 16 proton ⇒ Nguyên tử S
- Số proton = số hiệu nguyên tử = 16 ⇒ Z = 16
- Số khối = số proton + số neutron = 16 + 16 = 32
⇒ Kí hiệu nguyên tử X: .
Lời giải:
Kí hiệu nguyên tử của các đồng vị silicon là: , và .
Bài 3 trang 25 Hóa học 10: Hoàn thành những thông tin chưa biết trong bảng sau:
|
Đồng vị |
? |
? |
|
? |
? |
|
Số hiệu nguyên tử |
? |
? |
? |
9 |
11 |
|
Số khối |
? |
? |
? |
? |
23 |
|
Số proton |
16 |
? |
? |
? |
? |
|
Số neutron |
16 |
20 |
? |
10 |
? |
|
Số electron |
? |
20 |
? |
? |
? |
Lời giải:
|
Đồng vị |
|
|
|
|
|
|
Số hiệu nguyên tử |
16 |
20 |
30 |
9 |
11 |
|
Số khối |
32 |
40 |
65 |
19 |
23 |
|
Số proton |
16 |
20 |
30 |
9 |
11 |
|
Số neutron |
16 |
20 |
35 |
10 |
12 |
|
Số electron |
16 |
20 |
30 |
9 |
11 |
Lời giải:
Gọi % số nguyên tử của mỗi đồng vị 24Mg, 25Mg lần lượt là x, y.
Theo bài ta có hệ phương trình sau:
Xem thêm lời giải bài tập SGK Hoá học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Bài 2: Thành phần của nguyên tử
Bài 4: Cấu trúc lớp vỏ electron của nguyên tử
Bài 5: Cấu tạo bảng tuần hoàn các nguyên tố hóa học
Bài 7: Định luật tuần hoàn - Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học