Giải Hoá Học 10 Bài 6: Xu hướng biến đổi một số tính chất của nguyên tử các nguyên tố, thành phần và một số tính chất của hợp chất trong một chu kì và nhóm
Lời giải:
Khả năng phản ứng với nước của các kim loại trên là khác nhau. Khả năng phản ứng với nước tăng dần từ Li đến Fr trong nhóm IA do tính kim loại tăng dần.
Xu hướng biến đổi tính kim loại, tính phi kim:
Tính kim loại, tính phi kim của các nguyên tố nhóm A có xu hướng biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân:
- Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, lực hút giữa hạt nhân với các electron lớp ngoài cùng tăng. Do đó, tính kim loại của các nguyên tố giảm dần, tính phi kim tăng dần.
- Trong một nhóm, theo chiều tăng dần của điện tích hạt nhân, lực hút giữa hạt nhân với các electron lớp ngoài cùng giảm. Do đó tính kim loại của các nguyên tố tăng dần, tính phi kim giảm dần.
1. Bán kính nguyên tử
Lời giải:
- Trong mỗi chu kì, bán kính nguyên tử của các nguyên tố có xu hướng giảm dần từ trái sang phải.
- Trong mỗi nhóm, bán kính nguyên tử có xu hướng tăng dần từ trên xuống dưới.
Lời giải:
Xu hướng biến đổi bán kính nguyên tử của các nguyên tố trong mỗi chu kì và trong mỗi nhóm A do điện tích hạt nhân nguyên tử gây ra.
- Trong một chu kì, nguyên tử của các nguyên tố có cùng số lớp electron. Từ trái sang phải, điện tích hạt nhân nguyên tử tăng dần nên electron lớp ngoài cùng sẽ bị hạt nhân hút mạnh hơn, vì vậy bán kính nguyên tử của các nguyên tố có xu hướng giảm dần.
- Trong một nhóm, theo chiều từ trên xuống dưới, số lớp electron tăng dần nên bán kính nguyên tử có xu hướng tăng.
Lời giải:
- Các nguyên tố Li (Z = 3), N (Z = 7), O (Z = 8) cùng thuộc chu kì 2 trong bảng tuần hoàn.
Trong cùng một chu kì, theo chiều tăng dần điện tích hạt nhân nguyên tử, bán kính nguyên tử có xu hướng giảm.
⇒ Bán kính nguyên tử tăng dần theo thứ tự: O < N < Li (2)
- Các nguyên tố Li (Z = 3), Na (Z = 11), K (Z = 19) cùng thuộc nhóm IA trong bảng tuần hoàn.
Trong cùng một nhóm, theo chiều tăng dần điện tích hạt nhân nguyên tử bán kính nguyên tử có xu hướng tăng.
⇒ Bán kính nguyên tử tăng dần theo thứ tự: Li < Na < K (2)
Từ (1) và (2) ⇒ Bán kính nguyên tử tăng dần theo thứ tự: O < N < Li < Na < K.
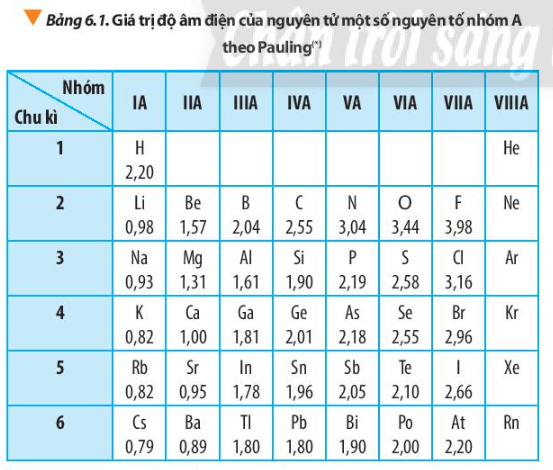
2. Độ âm điện
Lời giải:
Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, lực hút giữa hạt nhân với các electron lớp ngoài cùng cũng tăng. Do đó, độ âm điện của nguyên tử các nguyên tố có xu hướng tăng dần.
Trong một nhóm, theo chiều tăng dần của điện tích hạt nhân, bán kính nguyên tử tăng nhanh, lực hút giữa hạt nhân với các electron lớp ngoài cùng giảm, do đó độ âm điện của nguyên tử các nguyên tố có xu hướng giảm dần.
Lời giải:
Vì các nguyên tố nhóm VIIIA là khí trơ. Mà do khí trơ hầu như không nhường nhận electron, và độ âm điện lại đại diện cho khả năng hút electron nên không xác định được độ âm điện.
Lời giải:
- Các nguyên tố Na (Z = 11), Mg (Z = 12), Al (Z = 13) thuộc cùng chu kì 3.
Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, độ âm điện của nguyên tử các nguyên tố có xu hướng tăng dần.
⇒ Thứ tự tăng dần độ âm điện: Na < Mg < Al (1)
- Các nguyên tố Na (Z = 11), K (Z = 19) cùng thuộc nhóm IA.
Trong một nhóm, theo chiều tăng dần của điện tích hạt nhân, độ âm điện của nguyên tử các nguyên tố có xu hướng giảm dần.
⇒ Thứ tự tăng dần độ âm điện: K < Na (2)
Từ (1) và (2) ⇒ Thứ tự tăng dần độ âm điện: K < Na < Mg < Al.
3. Tính kim loại, tính phi kim
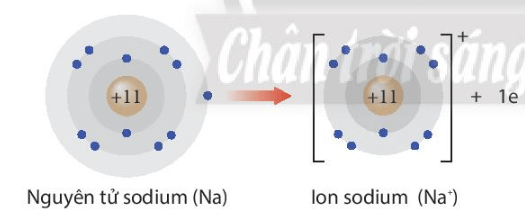
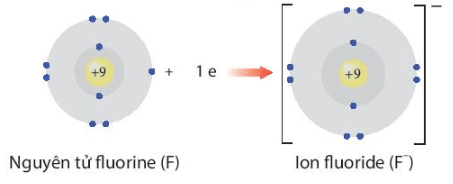
Câu hỏi 5 trang 45 Hóa học 10: Giải thích sự hình thành ion Na+ và ion F-
Lời giải:
Na → Na+ + 1e
Na nhường 1 electron để trở thành Na+
F + 1e → F-
F nhận 1 electron để trở thành F-
a) đi từ đầu chu kì đến cuối chu kì?
b) đi từ đầu nhóm đến cuối nhóm?
Lời giải:
Khả năng nhường hoặc nhận electron hóa trị của nguyên tử các nguyên tố nhóm A:
a) đi từ đầu chu kì đến cuối chu kì, khả năng nhường electron hóa trị giảm dần, khả năng nhận electron hóa trị tăng dần.
b) đi từ đầu nhóm đến cuối nhóm, khả năng nhường electron hóa trị tăng dần, khả năng nhận electron hóa trị giảm dần.
Lời giải:
- Các nguyên tố sodium (Na, Z = 11), magnesium (Mg, Z = 12) cùng thuộc chu kì 3.
Trong một chu kì, theo chiều tăng của điện tích hạt nhân, tính kim loại của các nguyên tử nguyên tố giảm dần, phi kim tăng dần.
⇒ Tính kim loại giảm dần theo thứ tự: Na > Mg (1)
- Các nguyên tố sodium (Na, Z = 11), potassium (K, Z = 19) cùng thuộc nhóm IA.
Trong một nhóm, theo chiều tăng của điện tích hạt nhân, tính kim loại của các nguyên tố tăng dần, tính phi kim giảm dần.
⇒ Tính kim loại giảm dần theo thứ tự: K > Na (2)
Từ (1) và (2) ⇒ Tính kim loại giảm dần theo thứ tự: K > Na > Mg.
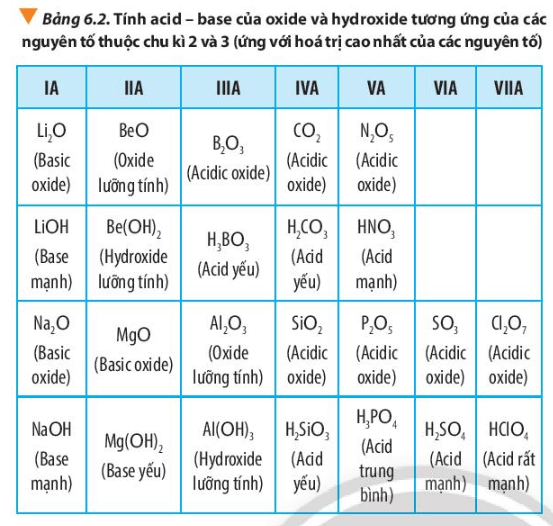
4. Tính acid - base của oxide và hydroxide
Lời giải:
Na2O phản ứng với acid ⇒ Na2O là basic oxide
Al2O3 phản ứng với cả acid và base ⇒ Al2O3 là oxide lưỡng tính
SO3 phản ứng với base ⇒ SO3 là acidic oxide
NaOH phản ứng với acid ⇒ NaOH là base
Al(OH)3 phản ứng với cả acid và base ⇒ Al(OH)3 là hydroxide lưỡng tính
H2SO4 phản ứng với base ⇒ H2SO4 là acid
Lời giải:
Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính base của oxide và hydroxide tương ứng giảm dần, tính acid của chúng tăng dần.
Lời giải:
Trong cùng 1 chu kì, theo chiều tăng dần của điện tích hạt nhân, tính acid của hydroxide tương ứng của các nguyên tố trong bảng tuần hoàn tăng dần.
⇒ Sắp xếp theo chiều giảm dần tính acid: HClO4 > H2SO4 > H3PO4 > H2SiO3.
Lời giải:
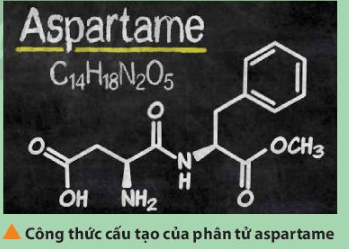
Các nguyên tố có trong phân tử aspartame gồm: C (Z = 6), H (Z = 1), N (Z = 7), O (Z = 8)
Dựa vào bảng tuần hoàn ta xác định được:
C (Z = 6) thuộc ô số 6, nhóm IVA, chu kì 2;
H (Z = 1) thuộc ô số 1 nhóm IA, chu kì 1;
N (Z = 7) thuộc ô số 7, nhóm VA, chu kì 2;
O (Z = 8) thuộc ô số 8, nhóm VIA, chu kì 2;
Các nguyên tố C (Z = 6), N (Z = 7), O (Z = 8) đều thuộc chu kì 2.
Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính phi kim tăng dần.
Bên cạnh đó H có tính phi kim yếu.
⇒ O có tính phi kim mạnh nhất
Bài tập (trang 47 - 48)
Bài 1 trang 47 Hóa học 10: Nguyên tử của nguyên tố nào sau đây có bán kính nhỏ nhất?
Lời giải:
Đáp án đúng là: B
Trong một chu kì, theo chiều tăng của điện tích hạt nhân, bán kính nguyên tử giảm dần.
Trong một nhóm, theo chiều tăng của điện tích hạt nhân, bán kính nguyên tử tăng dần.
Si (Z = 14), P (Z = 15) cùng thuộc chu kì 3.
⇒ Bán kính: Si > P (1)
Si (Z = 14), Ge (Z = 32) cùng thuộc nhóm IVA
⇒ Bán kính: Ge > Si (2)
Từ (1), (2) ⇒ Ge > Si > P
P (Z = 15), As (Z = 33) cùng thuộc nhóm VA
⇒ Bán kính: As > P
Vậy bán kính của P (Z = 15) là nhỏ nhất.
Lời giải:
Đáp án đúng là: B
Trong một nhóm, theo chiều tăng dần của điện tích hạt nhân, tính kim loại của các nguyên tố tăng dần, tính phi kim giảm dần.
⇒ Sắp xếp theo chiều tính phi kim tăng dần: Q, M, E, D.
Bài 3 trang 48 Hóa học 10: Xét ba nguyên tố có cấu hình electron lần lượt là:
Tính base tăng dần của các hydroxide là:
Lời giải:
Đáp án đúng là: C
Dựa vào cấu hình electron ta thấy các nguyên tố trên đều thuộc chu kì 3 trong bảng tuần hoàn.
Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính base của oxide và hydroxide tương ứng giảm dần.
⇒ Sắp xếp theo chiều tính base tăng dần: Z(OH)3 < Q(OH)2 < XOH.
Lời giải:
Trong bảng tuần hoàn các nguyên tố hóa học nguyên tố F có tính phi kim mạnh nhất.
Vì trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính phi kim tăng dần. Trong một nhóm, theo chiều tăng dần của điện tích hạt nhân, tính phi kim giảm dần.
Nguyên tố flo nằm ở cuối chu kì 2 và đầu nhóm VIIA nên có tính phi kim mạnh nhất.
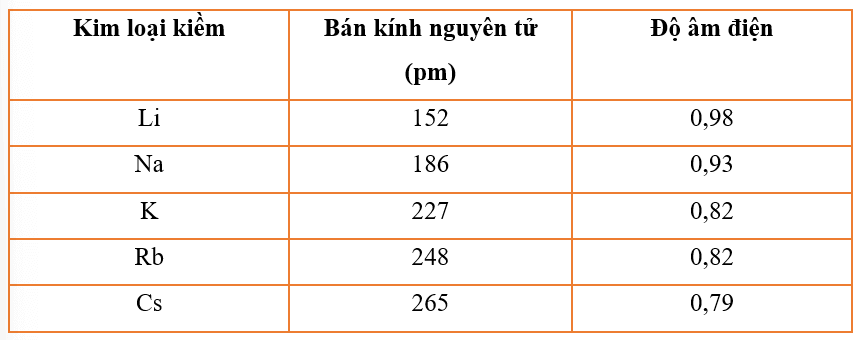
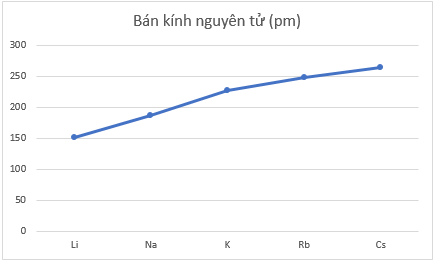
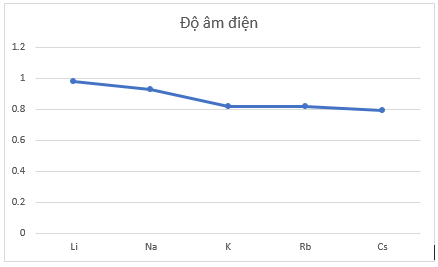
Bài 5 trang 48 Hóa học 10: Cho bảng số liệu sau:
Lời giải:
- Đồ thị với hai đại lượng bán kính nguyên tử và độ âm điện trong bảng bằng số liệu trên:
- Nhận xét:
Trong một nhóm:
+ Theo chiều tăng dần của điện tích hạt nhân, bán kính nguyên tử tăng do số lớp electron tăng.
+ Theo chiều tăng dần của điện tích hạt nhân, độ âm điện giảm. Vì số lớp electron tăng dần từ trên xuống dưới nên lực hút giữa hạt nhân với các electron lớp ngoài cùng giảm nên độ âm điện giảm.
Xem thêm lời giải bài tập SGK Hoá học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Bài 4: Cấu trúc lớp vỏ electron của nguyên tử
Bài 5: Cấu tạo bảng tuần hoàn các nguyên tố hóa học
Bài 7: Định luật tuần hoàn - Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học