Giải Hoá Học 10 Bài 7: Định luật tuần hoàn - Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
Lời giải:
Fluorine thuộc ô số 9, chu kì 2, nhóm VIIA trong bảng tuần hoàn (là nhóm phi kim điển hình).
Cấu hình electron của F là: 1s22s22p5 ⇒ Có 7 electron lớp ngoài cùng. Khi hình thành liên kết hóa học F có xu hướng nhận thêm 1 electron để đạt được cấu hình electron bền vững của khí hiếm ⇒ F có tính oxi hóa mạnh.
1. Định luật tuần hoàn
Lời giải:
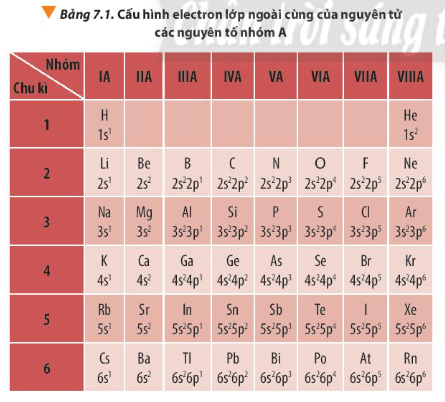
Với các nguyên tố nhóm A trong bảng tuần hoàn:
- Trong một chu kì, theo chiều tăng dần điện tích hạt nhân thì số electron lớp ngoài cùng tăng dần.
- Trong một nhóm, các nguyên tử có số electron lớp ngoài cùng bằng nhau (trừ He).
Lời giải:
Xu hướng biến đổi một số tính chất của các nguyên tố, đơn chất và hợp chất:
- Bán kính nguyên tử:
+ Trong một chu kì, theo chiều tăng dần điện tích hạt nhân, bán kính nguyên tử của các nguyên tố có xu hướng giảm dần.
+ Trong một nhóm, theo chiều tăng dần điện tích hạt nhân, bán kính nguyên tử của các nguyên tố có xu hướng tăng.
- Độ âm điện:
+ Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, độ âm điện của nguyên tử các nguyên tố có xu hướng tăng dần.
+ Trong một nhóm, theo chiều tăng dần của điện tích hạt nhân, độ âm điện của nguyên tử các nguyên tố có xu hướng giảm dần.
- Tính kim loại, tính phi kim:
+ Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính kim loại của các nguyên tố giảm dần, tính phi kim tăng dần.
+ Trong một nhóm, theo chiều tăng dần của điện tích hạt nhân, tính kim loại của các nguyên tố tăng dần, tính phi kim giảm dần.
- Tính aid – base của oxide và hydroxide: Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính base của oxide và hydroxide tương ứng giảm dần, tính acid của chúng tăng dần.
- Số electron lớp ngoài cùng trong một chu kì: Trong một chu kì, theo chiều tăng dần điện tích hạt nhân thì số electron lớp ngoài cùng tăng dần.
2. Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
Lời giải:
Cấu tạo nguyên tử Ca:
Cấu hình electron: 1s22s22p63s23p64s2
Số proton, số electron: 20
Số lớp electron: 4
Số electron lớp ngoài cùng: 2
Ví trí nguyên tố Ca
Số thứ tự nguyên tố: 20
Số thứ tự chu kì: 4
Nhóm: IIA
Tính chất nguyên tố Ca
Tính kim loại, tính phi kim: kim loại mạnh
Hóa trị cao nhất với oxygen: 2
Công thức oxide cao nhất: CaO
Công thức hydroxide tương ứng: Ca(OH)2
Tính acid, base của oxide cao nhất và hydroxide: base mạnh
Lời giải:
a) Nguyên tố potassium thuộc ô 19.
⇒ Số hiệu nguyên tử Z = 19 = số proton = số electron.
Cấu hình electron K (Z = 19): 1s22s22p63s23p64s1.
Số lớp electron: 4.
Số electron lớp ngoài cùng: 1.
b) Nguyên tử của nguyên tố chlorine có 17 proton.
⇒ Số thứ tự nguyên tố: 17
Cấu hình electron: 1s22s22p63s23p5.
Số thứ tự chu kì = số lớp electron = 3
Số thứ tự nhóm VIIA (do 7 electron lớp ngoài cùng, nguyên tố p).
c) Nguyên tử của nguyên tố sulfur thuộc ô 16
⇒ Số hiệu nguyên tử Z = số proton = số electron = 16
Cấu hình electron: 1s22s22p63s23p4
Dựa vào cấu hình electron ta thấy nguyên tử nguyên tố sulfur có 6 electron lớp ngoài cùng
⇒ Là phi kim
Hóa trị cao nhất với oxygen là VI.
Công thức oxide cao nhất: SO3 là acidic oxide.
Công thức hydroxide tương ứng: H2SO4 là acid mạnh.
Lời giải:
Potassium hydroxide (KOH) được sử dụng để sản xuất chất tẩy rửa, thuốc nhuộm vải, phân bón, … ⇒ Potassium hydroxide (KOH) hoạt động hóa học mạnh.
⇒ Dự đoán hydroxide này có tính base mạnh.
Ngoài ra, dựa vào K thuộc nhóm IA trong bảng tuần hoàn, có thể dự đoán KOH có tính base mạnh.
Bài tập (trang 51)
Bài 1 trang 51 Hóa học 10: Các nguyên tố trong bảng tuần hoàn được sắp xếp theo chiều tăng dần
Lời giải:
Đáp án đúng là C
Các nguyên tố trong bảng tuần hoàn được sắp xếp theo chiều tăng dần số hiệu nguyên tử.
A. Số electron ở vỏ nguyên tử của nguyên tố Ca là 20
B. Vỏ của nguyên tử Ca có 4 lớp electron và lớp ngoài cùng có 2 electron
C. Hạt nhân của nguyên tố Ca có 20 proton
D. Nguyên tố Ca là một phi kim
Lời giải:
Đáp án đúng là: D
Nguyên tố Ca có số hiệu nguyên tử là 20
⇒ Số hiệu nguyên tử Z = số proton = số electron = 20
Cấu hình electron: 1s22s22p63s23p64s2
⇒ Vỏ của nguyên tử Ca có 4 lớp electron và lớp ngoài cùng có 2 electron.
⇒ Nguyên tố Ca là một kim loại.
Lời giải:
Nguyên tố này là Al (nhôm) nằm ở ô số 13, chu kì 3, nhóm IIIA trong bảng tuần hoàn
Cấu tạo nguyên tử:
Cấu hình electron: 1s22s22p63s23p1
Số proton, số electron: 13
Số lớp electron: 3
Số electron lớp ngoài cùng: 3
Tính chất nguyên tố Al:
Tính kim loại, tính phi kim: là kim loại có tính khử mạnh
Hóa trị cao nhất với oxygen: 3
Công thức oxide cao nhất: Al2O3
Công thức hydroxide tương ứng: Al(OH)3
Tính acid, base của oxide cao nhất và hydroxide: là oxide và hydroxide lưỡng tính.
Lời giải:
Nguyên tố này là Ca
Ví trí nguyên tố Ca:
Số thứ tự nguyên tố: 20
Số thứ tự chu kì: 4
Nhóm: IIA
Tính chất nguyên tố Ca
Tính kim loại, tính phi kim: kim loại mạnh
Hóa trị cao nhất với oxygen: 2
Công thức oxide cao nhất: CaO
Công thức hydroxide tương ứng: Ca(OH)2.
Tính acid, base của oxide cao nhất và hydroxide: base mạnh
Xem thêm lời giải bài tập SGK Hoá học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Bài 5: Cấu tạo bảng tuần hoàn các nguyên tố hóa học