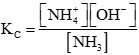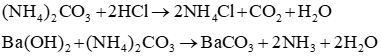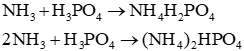Giải SBT Hoá học 11 Bài 5: Ammonia. Muối ammonium
A. Nitrogen.
B. Ammonia.
C. Oxygen.
D. Hydrogen
Lời giải:
Đáp án đúng là: B
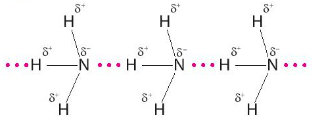
Ở trạng thái lỏng nguyên chất, phân tử chất tạo được liên kết hydrogen với nhau là ammonia.
A. Nitrogen.
B. Hydrogen.
C. Ammonia.
D. Oxygen.
Lời giải:
Đáp án đúng là: C
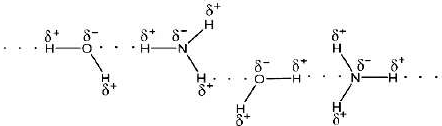
Khí dễ tan trong nước do tạo được liên kết hydrogen với nước là ammonia.
Bài 5.3 trang 18 Sách bài tập Hóa học 11: Nhận định nào sau đây về phân tử ammonia không đúng?
A. Phân cực mạnh.
B. Có một cặp electron không liên kết.
C. Có độ bền nhiệt rất cao.
D. Có khả năng nhận proton.
Lời giải:
Đáp án đúng là: C
Nhận định về phân tử ammonia không đúng là có độ bền nhiệt rất cao. Do có năng lượng liên kết nhỏ nên phân tử ammonia có độ bền nhiệt rất thấp.
A. acid.
B. base.
C. chất oxi hoá.
D. chất khử?.
Lời giải:
Đáp án đúng là: B
Khi tác dụng với nước và hydrochloric acid, ammonia đóng vai trò là base do phân tử ammonia nhận proton.
A. NO.
B. N2.
C. N2O.
D. NO2.
Lời giải:
Đáp án đúng là: A
Trong phương pháp Ostwald, ammonia bị oxi hoá bởi oxygen không khí tạo thành sản phẩm chính là NO.
4NH3 + 5O2 4NO + 6H2O
A. HCl.
B. H2SO4.
C. H3PO4.
D. AlCl3.
Lời giải:
Đáp án đúng là: D
Cho dung dịch NH3 vào dung dịch thu được kết tủa trắng là AlCl3
3NH3 + 3H2O + AlCl3 → Al(OH)3↓ + 3NH4Cl
A. Hồng.
B. Xanh.
C. Không màu.
D. Vàng.
Lời giải:
Đáp án đúng là: A
Cho vài giọt dung dịch phenolphthalein vào dung dịch NH3, phenolphthalein chuyển sang màu hồng do dung dịch NH3 có tính base yếu.
A. NaCl.
B. CaCO3.
C. KClO3,
D. (NH4)2CO3.
Lời giải:
Đáp án đúng là: D
Muối bị nhiệt phân hoàn toàn thu được sản phẩm chỉ gồm khí và hơi là (NH4)2CO3
A. KCl.
B. KNO3.
C. KOH.
D. K2SO4.
Lời giải:
Đáp án đúng là: C
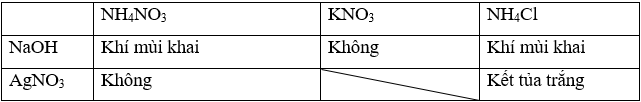
Phân biệt được đung dịch NH4Cl và NaCl bằng thuốc thử là dung dịch KOH.
Hiện tượng: Thêm KOH vào dung dịch NH4Cl thấy xuất hiện khí mùi khai, còn thêm vào dung dịch NaCl không thấy hiện tượng gì.
NH4Cl + KOH → KCl + NH3↑ + H2O
Khí mùi khai là NH3.
A. NH3.
B. .
C. .
D. N2.
Lời giải:
Đáp án đúng là: B
Phương trình cho proton của NH4+
NH4+ + H2O → NH3 + H3O+
A. 2.
B. 1.
C. 4 .
D. 3 .
Lời giải:
Đáp án đúng là: A
Các nhận định đúng là (1) chứa liên kết cộng hoá trị và (4) chứa nguyên tử N có số oxi hoá là -3.
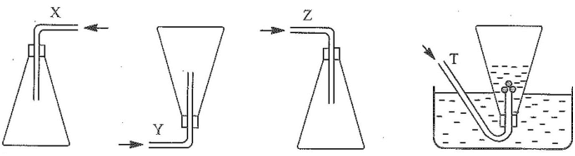
Nhận xét nào sau đây không đúng?
A. X là chlorine.
B. Y là hydrogen.
C. Z là nitrogen dioxide.
D. T là ammonia.
Lời giải:
Đáp án đúng là: D
Ammonia là chất khí tan nhiều trong nước nên không được thu bằng phương pháp đẩy nước.
Bài 5.13 trang 20 Sách bài tập Hóa học 11: Phát biểu nào sau đây không đúng?
A. Ammonia là base Brønsted khi tác dụng với nước.
B. Ammonia được sử dụng là chất làm lạnh.
C. Muối ammonium là tinh thể ion, dễ tan trong nước.
D. Các muối ammonium đều rất bền với nhiệt.
Lời giải:
Đáp án đúng là: D
Các muối ammonia đều kém bền với nhiệt. Ví dụ:
A. 1.
B. 3.
C. 2.
D. 4.
Lời giải:
Đáp án đúng là: B
Các thí nghiệm thu được kết tủa là:
(a) NH3 và AlCl3: 3NH3 + 3H2O + AlCl3 → Al(OH)3↓ + 3NH4Cl
(b) (NH4)2SO4 và Ba(OH)2: (NH4)2SO4 + Ba(OH)2 → BaSO4↓ + 2NH3 + 2H2O
(c) NH4Cl và AgNO3: NH4Cl + AgNO3 → AgCl↓ + NH4NO3
Bài 5.15 trang 20 Sách bài tập Hóa học 11: Xét cân bằng hoá học:
Cân bằng sẽ chuyển dịch theo chiều thuận khi cho thêm vài giọt dung dịch nào sau đây?
A. NH4Cl
B. NaOH.
C. HCl.
D. NaCl.
Lời giải:
Đáp án đúng là: C
Khi thêm HCl (tăng nồng độ acid), cân bằng chuyển dịch theo chiều giảm nồng độ acid tức là tăng nồng độ base. Do vậy, cân bằng chuyển dịch theo chiều thuận.
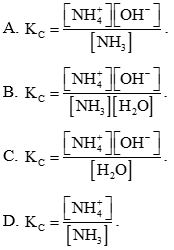
Bài 5.16 trang 20 Sách bài tập Hóa học 11: Xét cân bằng hoá học:
Hằng số cân bằng (Kc) của phản ứng được biểu diễn bằng biểu thức nào sau đây?
Lời giải:
Đáp án đúng là: A
Hằng số cân bằng (Kc) của phản ứng được biểu diễn bằng biểu thức
Bài 5.17 trang 20 Sách bài tập Hóa học 11: Xét cân bằng hoá học:
A. x < y.
B. x = y.
C. x > y.
D. 5x = 4y.
Lời giải:
Đáp án đúng là: C
∆H < 0, phản ứng tỏa nhiệt. Như vậy, khi tăng nhiệt độ, cân bằng chuyển dịch theo chiều nghịch (tức là chiều giảm nhiệt độ) Do đó, khi ở 400oC và 500oC ta có mối quan hệ giữa hiệu suất phản ứng là x > y.
Bài 5.18 trang 20 Sách bài tập Hóa học 11: Xét cân bằng hoá học:
A. 5x = 4y.
B. x = y.
C. x > y.
D. x < y.
Lời giải:
Đáp án đúng là: D
Khi tăng áp suất, cân bằng chuyển dịch theo chiều làm giảm áp suất tức là giảm số mol khí. Như vậy, mối quan hệ giữa hiệu suất phản ứng khi hệ đạt cân bằng ở 200 bar và 300 bar là x < y.
A. 20%.
B. 25%.
C. 30%.
D. 10%.
Lời giải:
Đáp án đúng là: B
Giả sử có 1 mol N2 và 4 mol H2.
Phương trình hoá học: N2 + 3H2 ⇌ 2NH3
Ban đầu: 1 4 0 mol
Phản ứng: x 3x 2x mol
Sau phản ứng: (1 – x) (4 – 3x) 2x mol
Tổng số mol khí sau phản ứng: nsau = (1 – x) + (4 – 3x) + 2x = 5 – 2x (mol).
Áp dụng định luật bảo toàn khối lượng có:
mtrước = msau ⇔ 28.1 + 2.4 = (5 – 2x).4.2 Þ x = 0,25.
Giả sử H = 100% thì N2 hết, do đó hiệu xuất phản ứng tính theo N2.
Ta có: H = = 25%.
A. 25%.
B. 23%.
C. 16%.
D. 20%.
Lời giải:
Đáp án đúng là: D
Giả sử ban đầu có x mol N2 và y mol H2.
Ta có:
Giả sử có 1 mol N2 và 4 mol H2. Vậy số mol ban đầu là 5 mol.
Phương trình hoá học: N2 + 3H2 ⇌ 2NH3
Ban đầu: 1 4 0 mol
Phản ứng: x 3x 2x mol
Sau phản ứng: (1 – x) (4 – 3x) 2x mol
Tổng số mol khí sau phản ứng: nsau = (1 – x) + (4 – 3x) + 2x = 5 – 2x (mol).
Số mol Y giảm 8% so với ban đầu
Giả sử H = 100% thì N2 hết, do đó hiệu xuất phản ứng tính theo N2.
Ta có: H = = 20%.
b) Trình bày phương pháp hoá học phân biệt ba dung dịch: NH4NO3, KNO3, NH4Cl.
Lời giải:
a) Các phản ứng xảy ra:
b) Sử dụng lần lượt hai dung dịch thuốc thử là NaOH và AgNO3
Các phương trình hóa học:
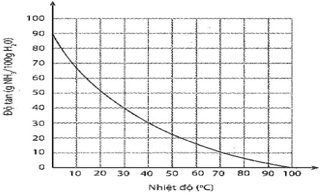
Sự phụ thuộc của độ tan khi ammonia vào nhiệt độ
Dựa vào đồ thị ở hình bên, hãy xác định:
a) Độ tan của ammonia ở 30oC. Nhận xét về tính tan của ammonia ở nhiệt độ này.
b) Nồng độ phần trăm của dung dịch ammonia bão hoà ở 30oC.
c) Độ tan của ammonia ở 60oC. So sánh với độ tan của ammonia ở 30oC. Giải thích.
Lời giải:
a) Ở 30 °C, độ tan của ammonia là 40 g NH3/100g nước. Nhận xét: Ở nhiệt độ này, ammonia tan tốt trong nước.
b) Nồng độ phần trăm của ammonia bão hoà:
c) Độ tan của ammonia ở 60 °C là 15 g /100 g nước.
Nhận xét: Độ tan của ammonia ở 60 °C đã giảm mạnh so với ở 30 °C.
Giải thích: Ở nhiệt độ cao hơn, các phân tử ammonia chuyển động nhiệt mạnh hơn, thoát khỏi dung dịch nhiều hơn, dẫn đến độ tan giảm.
Lời giải:
Nguyên tắc sản xuất nitrogen từ không khí là chưng cất phân đoạn không khí lỏng. Đầu tiên sẽ hoá lỏng không khí bằng cách tăng áp suất và làm lạnh xuống dưới –196 °C. Sau đó, tăng dần nhiệt độ, đến –196 °C thì nitrogen sôi và thoát ra; –186 °C thì argon sôi và thoát ra; chất lỏng còn lại là oxygen.
Bài 5.24 trang 21 Sách bài tập Hóa học 11: Xét cân bằng của dung dịch NH3 0,1 M 25oC:
Bỏ qua sự phân li của nước. Xác định giá trị pH của dung dịch trên.
Lời giải:
Kc
Ban đầu: 0,1 (mol/L)
Cân bằng: 0,1 - x x x (mol/L)
Bỏ qua sự phân li của nước. Xác định giá trị pH của dung dịch trên.
Lời giải:
Ban đầu: 0,05 0,10 (mol/L)
Cân bằng: 0,05 - x 0,10 + x x (mol/L)
a) Viết các phương trình hoá học.
Lời giải:
a) Phương trình hóa học sản xuất ammophos:
b) Số mol phosphoric acid đã phản ứng = 60 000 mol
Số mol ammonia cần dùng = 30 000 + 30 000.2 = 90 000 (mol)
Thể tích ammonia = 24,79 . 90 000 = 2 231 100 (lít) = 2 231,1 m3
Khối lượng ammophos thu được: 5,88 + 1,53 = 7,41 (tấn).
Xem thêm lời giải bài tập SBT Hoá học lớp 11 Kết nối tri thức hay, chi tiết khác:
Bài 6: Một số hợp chất của nitrogen với oxygen