Giải Sách bài tập Hóa học 10 Bài 9: Liên kết ion
Bài 9.1 trang 30 SBT Hóa học 10: Điều nào dưới đây đúng khi nói về ion S2-?
A. Có chứa 18 proton
B. Có chứa 18 electron
C. Trung hòa về điện
D. Được tạo thành khi nguyên tử sulfur (S) nhận vào 2 proton.
Lời giải:
Đáp án đúng là: B
A sai vì S2- có 16 proton.
C sai vì S2- là phần tử mang điện âm.
D sai vì S2- được tạo thành khi S nhận vào 2 electron.
A. Trong phân tử Na2O, các ion sodium Na+ và ion oxide O2- đều đạt cấu hình electron bền vững của khí hiếm neon.
B. Phân tử Na2O tạo bởi lực hút tĩnh điện giữa hai ion Na+ và một ion O2-
C. Là chất rắn trong điều kiện thường
D. Không tan trong nước, chỉ tan trong dung môi không phân cực như benzene, carbon tetrachloride, …
Lời giải:
Đáp án đúng là: D
Na2O phản ứng với nước tạo thành dung dịch trong suốt.
Na2O + 2H2O → 2NaOH.
Bài 9.3 trang 30 SBT Hóa học 10: Tính chất nào dưới đây đúng khi nói về hợp chất ion?
A. Hợp chất ion có nhiệt độ nóng chảy thấp
B. Hợp chất ion tan tốt trong dung môi không phân cực
C. Hợp chất ion có cấu trúc tinh thể
D. Hợp chất ion dẫn điện ở trạng thái rắn.
Lời giải:
Đáp án đúng là: C
A sai vì hợp chất ion có nhiệt độ nóng chảy cao.
B sai vì hợp chất ion tan tốt trong nước.
D sai vì hợp chất ion không dẫn điện khi ở trạng thái rắn.
A. sodium chloride
B. glucose
C. sucrose
D. fructose
Lời giải:
Đáp án đúng là: A
Hợp chất A ở thể rắn trong điều kiện thường, dễ tan trong nước tạo dung dịch dẫn điện được. Hợp chất A là hợp chất ion, do đó trong các đáp án chỉ có sodium chloride thỏa mãn.
Bài 9.5 trang 31 SBT Hóa học 10: Tính chất nào sau đây không phải của magnesium oxide (MgO)?
A. Có nhiệt độ nóng chảy cao hơn so với NaCl
B. Chất khí ở điều kiện thường
C. Có cấu trúc tinh thể
D. Phân tử tạo bởi lực hút tĩnh điện giữa ion Mg2+ và O2-
Lời giải:
Đáp án đúng là: B
Phát biểu B không đúng vì MgO là chất rắn ở điều kiện thường.
Lời giải:
Khi cho sodium phản ứng với sulfur, mỗi nguyên tử sodium sẽ nhường 1 electron để tạo thành Na+, mỗi nguyên tử sulfur sẽ nhận 2 electron từ 2 nguyên tử sodium nhường để tạo thành S2-.
Các ion được tạo thành mang điện tích trái dấu, hút nhau tạo thành phân tử Na2S (sodium sulfide):
2Na+ + S2- → Na2S.
Bài 9.7 trang 31 SBT Hóa học 10: Chỉ ra cấu trúc đúng của ô mạng tinh thể sodium chloride:
A.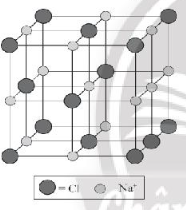
B.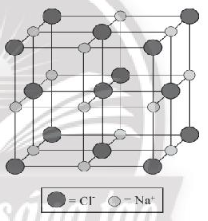
C.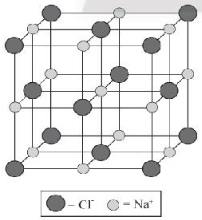
D.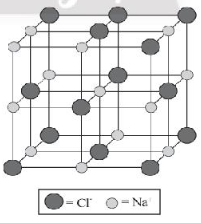
Lời giải:
Đáp án đúng là: C
Trong tinh thể sodium chloride, mỗi ion sodium được bao quanh bởi 6 ion chloride gần nhất và mỗi ion chloride cũng được bao quanh bởi 6 ion sodium gần nhất.
Lời giải:
Khi cho magnesium tác dụng với chlorine, nguyên tử magnesium sẽ nhường 2 electron cho 2 nguyên tử chlorine. Mỗi nguyên tử chlorine sẽ nhận 1 electron. Kết quả có sự hình thành ion Mg2+ và Cl-. Các ion được tạo thành mang điện tích trái dấu, hút nhau tạo thành phân tử MgCl2.
Lời giải:
Chú ý:
MNaCl = 58,5; nên lượng sodium người đó tiêu thụ trong một ngày là:
Có 2,042 gam = 2042 mg < 2300 gam.
Vậy lượng sodium tiêu thụ này còn nằm trong giới hạn cho phép.
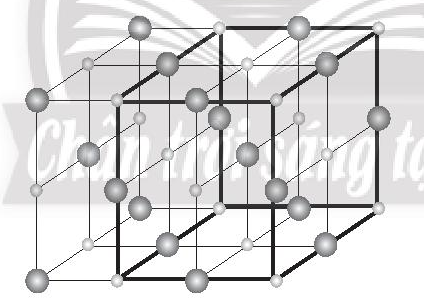
Bài 9.10 trang 32 SBT Hóa học 10: Trình bày cách vẽ một ô mạng tinh thể NaCl.
Bước 1: Vẽ một khối lập phương
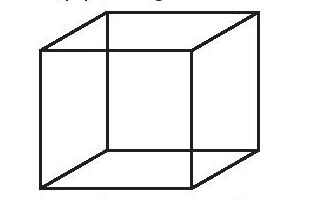
Bước 2: Chia khối lập phương đã vẽ thành 8 khối lập phương nhỏ bằng cách nối điểm giữa của mỗi cạnh với điểm giữa của cạnh đối diện và điểm giữa của mỗi mặt với điểm giữa của mặt đối diện.
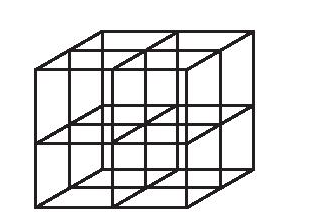
Bước 3: Đặt các ion sodium và ion chloride vào các đỉnh của khối lập phương và các điểm giữa của các cạnh cùng các mặt. Chú ý, ion chlorine có kích thước lớn hơn ion sodium. Tâm của khối lập phương không nhất thiết phải là ion sodium hay chlorine, nhưng bắt buộc các ion trái dấu phải luân phiên nhau trong không gian của mạng tinh thể.
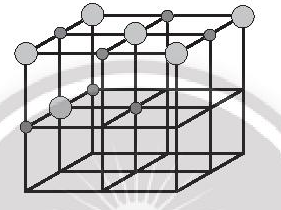
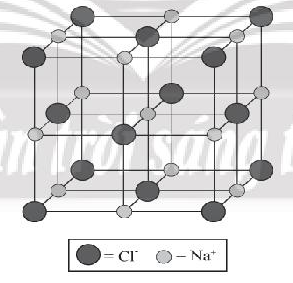
Bước 4: Tinh thể NaCl đã hoàn chỉnh:

Biểu đồ cho thấy khoảng cách giữa các ion càng gần càng thuận lợi để hệ đạt được trạng thái năng lượng tối thiểu (bền vững). Tuy nhiên, ở khoảng cách nhỏ quá, các ion lại đẩy nhau do hạt nhân của các ion đều mang điện tích dương. Năng lượng tối thiểu đại diện cho độ bền liên kết và khoảng cách ro tại mức năng lượng tối thiểu gọi là độ dài liên kết. Bằng cách thực hiện một loạt các phép tính, người ta thấy rằng các hợp chất ion được hình thành bởi các ion có điện tích lớn hơn sẽ tạo ra liên kết mạnh hơn và các chất ion có độ dài liên kết ngắn hơn sẽ hình thành liên kết mạnh hơn.
Sử dụng nhận định trên để dự đoán và giải thích độ bền liên kết giữa các hợp chất ion sau:
a. NaCl và Na2O
b. NaCl và NaF
Lời giải:
Do hợp chất ion được hình thành bởi các ion có điện tích lớn hơn sẽ tạo ra liên kết bền hơn và các hợp chất ion có độ dài liên kết ngắn hơn sẽ hình thành liên kết bền hơn nên:
a) NaCl và Na2O
Ion O2- có điện tích lớn hơn ion Cl-, ngoài ra kích thước ion O2- lại nhỏ hơn ion Cl- nên liên kết trong Na2O bền hơn so với NaCl.
b) NaCl và NaF
Tuy các ion Cl- và F- có cùng điện tích, nhưng kích thước ion F- nhỏ hơn ion Cl- nên liên kết trong NaF bền hơn trong NaCl.
Kết quả thực nghiệm đã chứng minh:
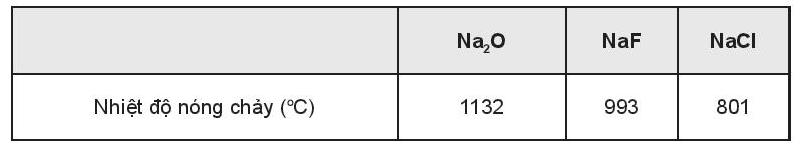
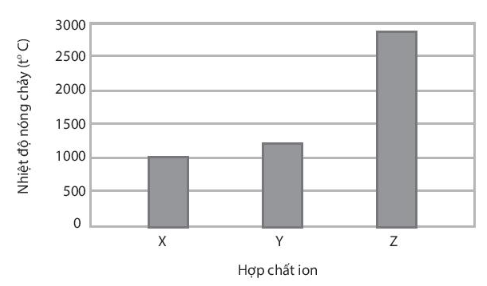
Trình bày cách xác định các chất X, Y, Z.
Lời giải:
Nhiệt độ nóng chảy của hợp chất ion là nhiệt độ tại đó có đủ năng lượng dưới dạng nhiệt để phá vỡ lực hút tĩnh điện mạnh giữa các ion và phá vỡ cấu trúc mạng tinh thể chuyển từ thể rắn sang thể lỏng.
Hợp chất ion có liên kết bền hơn sẽ có nhiệt độ nóng chảy cao hơn.
- Do điện tích anion hình thành hợp chất MgO cao hơn so với điện tích anion hình thành hợp chất MgF2, trong khi bán kính anion O2- và F- là khác biệt không đáng kể (O và F cùng thuộc chu kì 2) nên MgF2 phải có nhiệt độ nóng chảy thấp hơn MgO.
- Do điện tích cation hình thành hợp chất MgF2 cao hơn điện tích cation hình thành hợp chất NaF, trong khi bán kính cation Mg2+ lại nhỏ hơn bán kính cation Na+ nên NaF phải có nhiệt độ nóng chảy thấp hơn MgF2.
Vậy X là NaF; Y là MgF2 và Z là MgO.
Lời giải:
Do phân tử NaCl có |q1| = |q2| = 1 đơn vị điện tích; phân tử MgO có |q1| = |q2| = 2 đơn vị điện tích, ngoài ra bán kính cation Mg2+ lại nhỏ hơn bán kính cation Na+ và bán kính anion O2- cũng nhỏ hơn bán kính anion Cl- nên liên kết trong MgO bền hơn nhiều so với trong NaCl. Điều này dẫn đến nhiệt độ nóng chảy và nhiệt độ sôi của MgO cao hơn nhiều so với NaCl.
Thực nghiệm cho thấy, NaCl nóng chảy ở 801oC và sôi ở 1413oC; MgO nóng chảy ở 2850oC và sôi ở 3600oC.
Lời giải:
Do có sự khác nhau về kích thước và số lượng tương đối của các ion liên kết với nhau nên cấu trúc tinh thể của các hợp chất ion khác nhau sẽ có kích thước và hình dạng khác nhau.
Lời giải:
Do các hợp chất ion có cấu trúc tinh thể và lực hút tĩnh điện mạnh nên chúng thường tồn tại ở trạng thái rắn và cứng trong điều kiện thường. Tuy nhiên, chúng lại rất giòn do khi bị tác dụng bởi một lực, cứ một lớp ion bị khẽ dịch chuyển kéo theo toàn bộ sự sắp xếp sẽ bị xáo trộn do các ion trái dấu tự đẩy nhau, khiến mạng tinh thể bị vỡ.
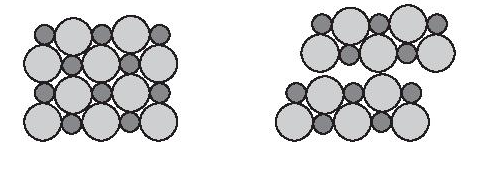
Lập phương tâm diện (kí hiệu là FCC: face centered cubic) là cấu trúc lập phương với 8 ion (hoặc nguyên tử) nằm ở các đỉnh hình lập phương và 6 ion (hoặc nguyên tử) khác nằm ở tâm của các mặt của hình lập phương.
Tinh thể NaCl được coi là sự đan xen giữa một mạng lập phương tâm diện của các anion với một mạng lập phương tâm diện của các cation.
Xem thêm lời giải sách bài tập Hóa học lớp 10 Chân trời sáng tạo hay, chi tiết khác:




