Công thức Lewis của HCN theo chương trình mới
1. Công thức Lewis của HCN
a) Cách 1: Viết công thức Lewis dựa vào công thức electron
Từ công thức electron, thay 1 cặp electron dùng chung bằng 1 gạch nối “–” giữa hai nguyên tử ta được công thức Lewis
Từ công thức electron của HCN, thay mỗi cặp electron bằng một gạch nối. Ta được công thức Lewis của HCN là:
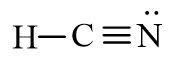
b) Cách 2: Viết công thức Lewis dựa theo các bước sau
Bước 1: Tính tổng số electron hóa trị trong phân tử
H có 1 electron hóa trị, C có 4 electron hóa trị, N có 5 electron hóa trị. Trong phân tử HCN có 1 nguyên tử H, 1 nguyên tử C và 1 nguyên tử N.
Vậy tổng số electron hóa trị = 1.1 + 4.1 + 5.1 = 10 electron.
Bước 2. Vẽ khung phân tử tạo bởi liên kết đơn giữa các nguyên tử
Trong phân tử HCN, trừ H thì nguyên tử C cần nhiều electron hơn để đạt octet. Vì vậy, C là nguyên tử trung tâm còn các nguyên tử N được xếp xung quanh:
H – C – N (1)
Bước 3. Tính số electron hóa trị chưa tham gia liên kết bằng cách lấy tổng số electron trừ số electron tham gia tạo liên kết.
Số electron hóa trị chưa tham gia liên kết trong sơ đồ là:
10 – 2.2 = 6 electron
Hoàn thiện octet cho các nguyên tử có độ âm điện lớn hơn trong sơ đồ.
Trong công thức (1), nguyên tử H đã đạt octet, xung quanh nguyên tử N mới có 2 electron nên cần phải bổ sung 6 electron vào nguyên tử này. Ta được công thức (2)
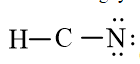 (2)
(2)
Nếu electron hóa trị còn dư, đặt số electron hóa trị dư trên nguyên tử trung tâm. Kiểm tra nguyên tử trung tâm đã đạt quy tắc octet chưa.
Nếu số electron hóa trị không còn dư mà nguyên tử trung tâm chưa đạt quy tắc octet, chuyển sang Bước 4.
Số electron hóa trị còn lại = 6 – 6 = 0
Nguyên tử trung tâm C có 4 electron hóa trị, chưa đạt octet.
Bước 4. Chuyển cặp electron chưa liên kết trên nguyên tử xung quanh thành electron liên kết sao cho nguyên tử trung tâm thỏa mãn quy tắc octet.
Vì C chưa đạt octet, cần chuyển hai cặp electron của nguyên tử N thành cặp electron chung giữa C và N để C đạt octet.
- Công thức Lewis của phân tử HCN thu được là:
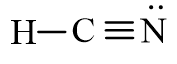
- Nhận xét:
+ ∆χ(C – H) = |2,55 – 2,2| = 0,35 < 0,4 ⇒ liên kết C – H trong phân tử HCN thuộc loại liên kết cộng hóa trị không phân cực.
+ ∆χ(C ≡ N) = |2,55 – 3,04| = 0,49 > 0,4 ⇒ liên kết C ≡ N trong phân tử HCN thuộc loại liên kết cộng hóa trị phân cực. Phân tử phân cực về phía nguyên tử N.
2. Công thức cấu tạo của HCN
Từ công thức Lewis, ta loại bỏ đi các electron tự do (electron không tham gia liên kết) thu được công thức cấu tạo.
- Công thức cấu tạo của HCN là:
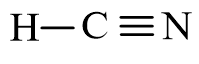
- Nhận xét:
+ Phân tử HCN có một liên kết đơn C – H và một liên kết ba C ≡ N (trong mỗi liên kết ba có 1 liên kết σ và 2 liên kết π).
+ Phân tử HCN có cấu tạo thẳng
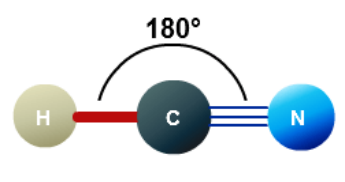
3. Công thức electron của HCN
- Sự tạo thành phân tử HCN:
Nguyên tử H có 1 electron hóa trị, cần thêm 1 electron để đạt octet.
Nguyên tử C có 4 electron hóa trị, cần thêm 4 electron để đạt octet.
Nguyên tử N có 5 electron hóa trị, cần thêm 3 electron để đạt octet.
Trong phân tử HCN, nguyên tử C góp chung 1 electron để tạo thành 1 cặp electron dùng chung với nguyên tử H. Nguyên tử C góp chung 3 electron với nguyên tử N để tạo thành 3 cặp electron dùng chung giữa C và N.
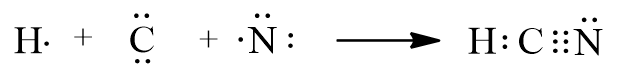
- Vậy công thức electron của HCN là:
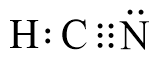
- Nhận xét:
+ Phân tử HCN có 4 cặp electron chung, trong đó 1 cặp electron chung giữa hai nguyên tử C và H, 3 cặp electron chung giữa C và N.
+ Phân tử HCN có 1 đôi electron tự do của nguyên tử N.
4. Bài tập mở rộng về HCN
Câu 1. Số liên kết σ và liên kết π trong phân tử HCN lần lượt là:
A. 1 và 2
B. 2 và 2
C. 1 và 1
D. 3 và 1
Hướng dẫn giải
Đáp án đúng là: B
Công thức cấu tạo của HCN là:
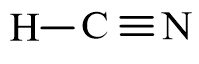
Phân tử HCN có một liên kết đơn C – H và một liên kết ba C ≡ N (trong mỗi liên kết ba có 1 liên kết σ và 2 liên kết π).
Câu 2. Những phát biểu sau về phân tử HCN:
(a) Phân tử HCN chỉ chứa liên kết cộng hóa trị.
(b) Phân tử HCN có 4 cặp electron dùng chung.
(c) Phân tử HCN không còn electron riêng.
(d) Phân tử HCN chứa hai liên kết đơn C – H và C –N.
Số phát biểu sai là:
A. 1
B. 2
C. 3
D. 4
Hướng dẫn giải
Đáp án đúng là: B
+ Trong phân tử HCN chỉ chứa liên kết cộng hóa trị trong đó liên kết C – H thuộc loại liên kết cộng hóa trị không phân cực, liên kết C ≡ N thuộc loại liên kết cộng hóa trị phân cực.
⇒ (a) đúng.
+ Dựa vào công thức electron ta thấy phân tử HCN có 4 cặp electron dùng chung, và 1 cặp electron riêng ⇒ (b) đúng, (c) sai.
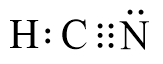
+ Dựa vào công thức cấu tạo ta thấy phân tử HCN có một liên kết đơn C – H và một liên kết ba C ≡ N ⇒ (d) sai.
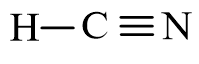
Vậy có hai phát biểu sai là (c) và (d).
Xem thêm các bài viết về Công thức Lewis của một số chất thường gặp hay và chi tiết khác:
Cách viết công thức Lewis (chương trình mới)
Công thức Lewis của CO2 (carbon dioxide) theo chương trình mới
Công thức Lewis của Cl2 theo chương trình mới
Công thức Lewis của H2 (Hydrogen) theo chương trình mới
Công thức Lewis của O2 (Oxygen) theo chương trình mới
Công thức Lewis của F2 theo chương trình mới
Công thức Lewis của N2 (nitrogen) theo chương trình mới
Công thức Lewis của HCl (hydrogen chloride) theo chương trình mới
Công thức Lewis của H2O theo chương trình mới
Công thức Lewis của H2S theo chương trình mới
Công thức Lewis của NH3 theo chương trình mới
Công thức Lewis của CH4 (Methane) theo chương trình mới
Công thức Lewis của SO2 theo chương trình mới
Công thức Lewis của CO theo chương trình mới
Công thức Lewis của SO3 theo chương trình mới
Công thức Lewis của HNO3 (Nitric acid) theo chương trình mới
Công thức Lewis của C2H2 theo chương trình mới
Công thức Lewis của C2H4 (Ethylene) theo chương trình mới
Công thức Lewis của CS2 (Carbon disulfide) theo chương trình mới
Công thức Lewis của HOCl theo chương trình mới
Công thức Lewis của PH3 theo chương trình mới
Công thức Lewis của CF4 theo chương trình mới
Công thức Lewis của F2O theo chương trình mới
Công thức Lewis của C2H6 (Ethane) theo chương trình mới
Công thức Lewis của CHCl3 theo chương trình mới
Công thức Lewis của PCl3 theo chương trình mới
Công thức Lewis của NCl3 theo chương trình mới
Công thức Lewis của CCl4 theo chương trình mới




