Hình bên là công thức Lewis của H2SO4. a) Dựa vào công thức Lewis của H2SO4
Bài 7.4 trang 23 SBT Hoá học 11: Hình bên là công thức Lewis của H2SO4.
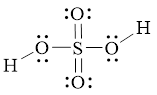
a) Dựa vào công thức Lewis của H2SO4, hãy cho biết số oxi hóa của nguyên tử sulfur trong phân tử.
b) Khi tham gia phản ứng, H2SO4 không thể tạo ra các sản phẩm chứa sulfur có số oxi hóa lớn hơn hoặc bằng 7. Giải thích.
c) Hydrogen iodide có tính khử khá mạnh. Hãy dự đoán khí này có phản ứng với sulfuric acid đặc không. Giải thích.
