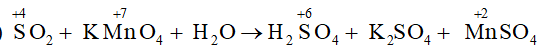Dẫn khí SO2 vào 100 mL dung dịch KMnO4 0,02M đến khi dung dịch vừa mất màu tím
148
24/01/2024
Bài 16.12 trang 44 SBT Hóa học 10: Dẫn khí SO2 vào 100 mL dung dịch KMnO4 0,02M đến khi dung dịch vừa mất màu tím.
Phản ứng xảy ra theo sơ đồ sau:
SO2 + KMnO4 + H2O → H2SO4 + K2SO4 + MnSO4
a) Lập phương trình hóa học của phản ứng theo phương pháp thăng bằng electron.
b) Xác định thể tích khí SO2 đã tham gia phản ứng ở điều kiện chuẩn.
Trả lời
a) 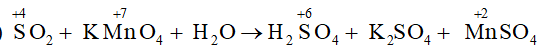
Xác định được hệ số của SO2 là 5, KMnO4 và MnSO4 là 2, sau đó cân bằng nguyên tố S và H tìm được hệ số của H2SO4 là 2, của H2O là 2.
5SO2 + 2KMnO4 + 2H2O → 2H2SO4 + K2SO4 + 2MnSO4
b) Theo phương trình hóa học ta có:
= 24,79.0,005 = 0,12395 L = 123,95 (mL)
Xem thêm các bài giải sách bài tập Vật Lí lớp 10 sách Kết nối tri thức với cuộc sống hay, chi tiết khác
Bài 14: Ôn tập chương 3
Bài 15: Phản ứng oxi hóa - khử
Bài 16: Ôn tập chương 4
Bài 17: Biến thiên enthalpy trong các phản ứng hóa học
Bài 18: Ôn tập chương 5
Bài 19: Tốc độ phản ứng