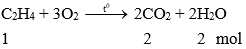Phản ứng C2H4 + H2 → C2H6
1. Phương trình phản ứng C2H4 ra C2H6
C2H4 + H2 → C2H6
CH2=CH2 + H2 → CH3-CH3
2. Điều kiện phương trình phản ứng xảy ra giữa Etilen H2
Nhiệt độ; Xúc tác: Ni
3. Bản chất của C2H4 (Etilen) trong phản ứng
Do liên kết kém bền trong liên kết đôi CH2=CH2 bị đứt ra nên mỗi phân tử etilen đã kết hợp thêm một phân tử hidro.
4. Mở rộng tính chất hóa học của Etilen
Trong phân tử etilen C2H4, có một liên kết đôi giữa hai nguyên tử cacbon, bao gồm 1 liên kết kém bền, dễ dàng đứt khi tiến hành phản ứng hóa học.
4.1. Etilen tác dụng với oxi
Khi đốt trong oxi, etilen cháy tạo thành khí CO2 và H2O, tỏa nhiều nhiệt.
- Etilen cháy hoàn toàn tạo ra CO2, H2O và tỏa nhiều nhiệt:
Phương trình hóa học
C2H4 + 3O2 → 2CO2+ 2H2O + Q
- Etilen làm mất màu dung dịch KMnO4:
CH2=CH2+ 4H2O + 2KMnO4 → 3HO-CH2-CH2-OH + 2MnO2 + 2KOH
4.2. Etilen tác dụng brom dạng dung dịch
Phương trình hóa học:
CH2= CH2 + Br2 → Br – CH2 – CH2 – Br
4.3. Etilen tác dụng H2
CH2=CH2 + H2 → CH3-CH3
4.4. Etilen tác dụng với H2O
Ở nhiệt độ thích hợp và có xúc tác axit, etilen có thể cộng nước
C2H4 + H2O C2H5OH
Với đặc điểm các chất liên kết đôi (tương tự etilen) dễ tham gia phản ứng cộng. Phân tử etilen kết hợp với nhau (còn gọi là phản ứng trùng hợp)
4.5. Phản ứng trùng ngưng
Các phân tử etilen kết hợp với nhau tạo ra chất có phân tử lượng rất lớn gọi là PolyEtiten hay còn gọi là PE
Phương trình phản ứng.
….+ CH2= CH2 + CH2= CH2 +….→ ….- CH2– CH2 – CH2– CH2-….
5. Câu hỏi vận dụng liên quan
Câu 1. Hỗn hợp X gồm H2 và C2H4 có tỷ khối so với He là 3,75. Dẫn X qua Ni nung nóng, thu được hỗn hợp khí Y có khối lượng so với He là 5. Hiệu suất của phẩn ứng hiđro hóa là
A. 20%
B. 25%
C. 50%
D. 40%
Lời giải:
Đáp án: C
MX = 3,75.4 = 15 (g/mol);
MY = 5.4 = 20 (g/mol)
Chọn 1 mol hỗn hợp X
→
Đặt số mol H2 phản ứng là a mol
C2H4 + H2 C2H6
Áp dụng định luật bảo toàn khối lượng:
mX = mY → 15.1 = 20.nY
→ nY = 0,75 mol
Số mol hỗn hợp giảm bằng số mol H2 phản ứng
→ a = 1 – 0,75 = 0,25 mol
→ H% = = 50%
Câu 2. Cho V lít hỗn hợp khí X gồm H2, C2H2, C2H4, trong đó số mol của C2H2 bằng số mol của C2H4 đi qua Ni nung nóng (hiệu suất đạt 100%), thu được 11,2 lít hỗn hợp khí Y ở đktc, biết tỉ khối hơi của hỗn hợp Y đối với H2 là 6,6. Nếu cho V lít hỗn hợp khí X đi qua dung dịch brom dư thì khối lượng bình brom tăng
A. 2,7 gam
B. 6,6 gam
C. 4,4 gam
D. 5,4 gam
Lời giải:
Đáp án: D
Vì hỗn hợp X có
→ Quy hh X về C2H3 và H2
MY = 13,2 → H2 dư → Y gồm H2 và C2H6 (a và b mol)
Ta có:
→ Khối lượng dung dịch tăng = 0,2.27 = 5,4 gam
Câu 3. Trong phân tử etilen giữa hai nguyên tử cacbon có
A. hai liên kết đôi.
B. một liên kết đôi.
C. một liên kết đơn.
D. một liên kết ba.
Lời giải:
Đáp án: B
Etilen: CH2=CH2 nhận thấy giữa 2 nguyên tử C có 1 liên kết đôi C=C.
Câu 4. Khi đốt cháy khí etilen thì số mol CO2 và H2O được tạo thành theo tỉ lệ
A. 2 : 1.
B. 1 : 2.
C. 1 : 3.
D. 1 : 1.
Lời giải:
Đáp án: D
Khi đốt cháy khí etilen thu được số mol CO2 bằng số mol nước.
Câu 5. Etilen và axetilen phản ứng được với tất cả các chất, dung dịch trong dãy nào sau đây?
A. H2, NaOH, dung dịch HCl.
B. CO2, H2, dung dịch KMnO4.
C. Dung dịch Br2, dung dịch HCl, dung dịch AgNO3/NH3 dư.
D. Dung dịch Br2, dung dịch HCl, dung dịch KMnO4.
Lời giải:
Đáp án: D
Câu 6. Có 4 chất: metan, etilen, but-1-in và but-2-in. Trong 4 chất đó, có mấy chất tác dụng được với dung dịch AgNO3 trong amoniac tạo thành kết tủa?
A. 4
B. 3
C. 2
D. 1
Lời giải:
Đáp án: D
Chỉ có but – 1 – in phản ứng được với AgNO3/NH3 thu được kết tủa.
Câu 7. Để khử hoàn toàn 200 ml dung dịch KMnO4 0,2M tạo thành chất rắn màu đen cần V lít khí C2H4 (đktc). Giá trị tối thiểu của V là
A. 2,240
B. 2,688
C. 4,480
D. 1,344
Lời giải:
Đáp án: D
3C2H4 + 2KMnO4 + 4H2O 3C2H4(OH)2 + 2MnO2(đen) + 2KOH
= 0,2.0,2 = 0,04 mol
Theo phương trình:
.
= 0,06 mol
→ V = 0,06.22,4 = 1,344 lít
Câu 8. Dẫn từ từ 6,72 lít (đktc) hỗn hợp X gồm etilen và propilen và dung dịch brom, dung dịch brom bị nhạt màu, và không có khí thoát ra. Khối lượng dung dịch sau phản ứng tăng 9,8 gam. Thành phần phần trăm theo thể tích của etilen trong X là
A. 50,00%
B. 66,67%
C. 57,14%
D. 28,57%
Lời giải:
Đáp án: B
%= .100 = 66,67%
Câu 9. Ba hiđrocacbon X, Y, Z kế tiếp nhau trong dãy đồng đẳng, trong đó khối lượng phân tử Z gấp đôi khối lượng phân tử X. Đốt cháy 0,1 mol chất Y, sản phẩm khi hấp thụ hoàn toàn vào dung dịch Ca(OH)2 dư, thu được số gam kết tủa là
A.30 gam
B. 10gam
C. 40 gam
D. 20 gam
Lời giải:
Đáp án: A
Phân tử Z hơn phân tử X 2 nhóm CH2 → MZ = MX + 28
Khối lượng phân tử Z gấp đôi khối lượng phân tử X → MZ = 2MX
→ 2MX = MX + 28 → MX = 28 → X là C2H4
Vậy Y là C3H6
Bảo toàn C có số mol CO2 sinh ra khi đốt Y là 3.0,1 = 0,3 mol
Hấp thụ CO2 vào Ca(OH)2 dư → = 0,3 mol
→ = 0,3.100 = 30 gam.
Câu 10. Hỗn hợp X gồm H2 và C2H4 có tỷ khối so với He là 3,75. Dẫn X qua Ni nung nóng, thu được hỗn hợp khí Y có khối lượng so với He là 5. Hiệu suất của phẩn ứng hiđro hóa là
A.20%
B. 25%
C. 50%
D. 40%
Lời giải:
Đáp án: C
MX = 3,75.4 = 15 (g/mol); MY = 5.4 = 20 (g/mol)
Chọn 1 mol hỗn hợp X
→
Đặt số mol H2 phản ứng là a mol
C2H4 + H2→ C2H6
Áp dụng định luật bảo toàn khối lượng:
mX = mY → 15.1 = 20.nY → nY = 0,75 mol
Số mol hỗn hợp giảm bằng số mol H2 phản ứng
→ a = 1 – 0,75 = 0,25 mol
→ H% = = 50%
Xem thêm các phương trình phản ứng hóa học khác:
C2H6 → C2H4 + H2 | C2H6 ra C2H4 | C2H6 ra H2
CH2=CH2 + Br2 → CH2Br–CH2Br | C2H4 + Br2 | Etilen + Br2
nCH2=CH2 → (-CH2-CH2 -)n | Trùng hợp etilen | Trùng hợp C2H4 | CH2=CH2 ra nhựa PE
C2H4 + H2O → C2H5OH | C2H4 ra C2H5OH
C2H4 + KMnO4 + H2O → C2H4(OH)2 + MnO2 + KOH | C2H4 ra C2H4(OH)2