Phương trình Al(OH)3 + HCl → AlCl3 + H2O
1. Phương trình phản ứng hóa học
Al(OH)3 + 3HCl → AlCl3 + 3H2O
2. Điều kiện phản ứng
- Điều kiện thường.
3. Hiện tượng nhận biết phản ứng
- Phản ứng hoà tan chất rắn nhôm hiđroxit và tạo dung dịch trong suốt.
4. Tính chất hoá học
a. Tính chất hoá học của Al(OH)3
- Kém bền với nhiệt: Khi đun nóng Al(OH)3 phân hủy thành Al2O3.
2Al(OH)3 
- Là hiđroxit lưỡng tính:
Tác dụng với axit mạnh:
Al(OH)3 + 3HCl → AlCl3 + 3H2O
Tác dụng với dung dịch kiềm mạnh:
Al(OH)3 + KOH → KAlO3 + 2H3O
Al(OH)3 + KOH → K[Al(OH)4]
b. Tính chất hoá học HCl
- Dung dịch axit HCl có đầy đủ tính chất hoá học của một axit mạnh.
Tác dụng chất chỉ thị:
Dung dịch HCl làm quì tím hoá đỏ (nhận biết axit)
HCl → H+ + Cl-
Tác dụng với kim loại
Tác dụng với KL (đứng trước H trong dãy Bêkêtôp) tạo muối (với hóa trị thấp của kim loại) và giải phóng khí hidrô (thể hiện tính oxi hóa)
Fe + 2HCl 
2Al + 6HCl 
Cu + HCl → không có phản ứng
Tác dụng với oxit bazo và bazo:
Sản phẩm tạo muối và nước
NaOH + HCl → NaCl + H2 O
CuO + 2HCl 
Fe2 O3 + 6HCl
Tác dụng với muối (theo điều kiện phản ứng trao đổi)
CaCO3 + 2HCl → CaCl2 + H2O + CO2↑
AgNO3 + HCl → AgCl↓ + HNO3
(dùng để nhận biết gốc clorua )
Ngoài tính chất đặc trưng là axit , dung dịch axit HCl đặc còn thể hiện vai trò chất khử khi tác dụng chất oxi hoá mạnh như KMnO4, MnO2, K2 Cr2O7, MnO2, KClO3 ……
4HCl + MnO2 
K2 Cr2 O7 + 14HCl → 3Cl2 + 2KCl + 2CrCl3 + 7H2 O
Hỗn hợp 3 thể tích HCl và 1 thể tích HNO3 đặc được gọi là hỗn hợp nước cường toan ( cường thuỷ) có khả năng hoà tan được Au ( vàng)
3HCl + HNO3 → 2Cl + NOCl + 2H2O
NOCl → NO + Cl
Au + 3Cl → AuCl3
5. Cách thực hiện phản ứng
- Cho Al(OH)3 phản ứng với dung dịch axit HCl tạo muối nhôm clorua và nước.
6. Bạn có biết
- Hidroxit không tan đều tác dụng với HCl tạo muối mới và nước.
7. Bài tập liên quan
Ví dụ 1: Phương trình hoá học nào sau đây sai?
A. Mg + H2SO4 → MgSO4 + H2
B. Al(OH)3 + 3HCl → AlCl3 +3H2O
C. Fe2O3 + 6HNO3 → 2Fe(NO3)3 + 3H2O
D. Fe3O4 + 4HNO3 → Fe(NO3)2 + 2Fe(NO3)3 + 4H2
Hướng dẫn giải
Chọn D.
3Fe3O4 + 28HNO3 → 9Fe(NO3)3 + NO + 14H2O
Ví dụ 2: Cho dãy các chất: ZnO, Al(OH)3, Zn(OH)2, NaHCO3 và BaSO4. Số chất trong dãy vừa phản ứng với dung dịch HCl vừa phản ứng với dung dịch NaOH là :
A. 2
B. 5
C. 3
D. 4
Hướng dẫn giải
Chọn D.
Các chất vừa tác dụng với HCl vừa tác dụng với NaOH là ZnO, Al(OH)3, Zn(OH)2, NaHCO3.
Ví dụ 3: Cần bao nhiêu ml dung dịch HCl 0,1M để hòa tan 15,6 gam Al(OH)3?
A. 6
B. 600
C. 6000
D. 3000
Hướng dẫn giải
Chọn C
Al(OH)3 + 3HCl → AlCl3 + 3H2O
nAl(OH)3=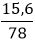
Theo phương trình phản ứng ta có: nHCl=3nAl(OH)3=3.0,2=0,6 mol
⇒ VHCl=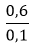
Ví dụ 4: Cho 100 ml dung dịch AlCl3 0,15M vào 250 ml dung dịch NaOH 0,2M, sau khi phản ứng xảy ra hoàn toàn, thu được m gam kết tủa. Giá trị của m là
A. 1,56
B. 0,78
C. 1,17
D. 1,30
Hướng dẫn giải
Chọn B
nAlCl3=0,015 mol→nAl3+=0,015 molnNaOH=0,05 mol→nOH−=0,05 mol
Phương trình hóa học:
Al3+ + 3OH– → Al(OH)3
0,015 → 0,045 → 0,015
Sau phản ứng, OH–dư: 0,05 – 0,045 = 0,005 mol
Al(OH)3 + OH– → AlO2– + 2H2O
0,005 ← 0,005
Sau phản ứng:
nAl(OH)3=0,015−0,005=0,01 mol
→ mkết tủa = 0,01.78 = 0,78 gam
Ví dụ 5: Cho từ từ đến hết 100 ml dung dịch NaOH 1,5M vào 50 ml dung dịch AlCl3 1,5M, sau khi các phản ứng xảy ra hoàn toàn thu được m gam kết tủa. Giá trị của m là
A. 12,4.
B. 7,8.
C. 15,6.
D. 3,9.
Hướng dẫn giải
Chọn D
nNaOH=0,15 mol→nOH−=0,15 molnAlCl3=0,075 mol→nAl3+=0,075 mol
Xét tỉ lệ nOH−nAl3+=2<3
Khi đó
nAl(OH)3=nOH−3=0,153=0,05 mol→m=mAl(OH)3=0,05.78
Ví dụ 6: Cho 200 ml dung dịch HCl 2M vào 100 ml dung dịch gồm NaOH 0,6M và NaAlO2 1M, phản ứng xong thu được m gam kết tủa. Giá trị của m là
A. 7,80.
B. 3,90.
C. 3,12.
D. 1,56.
Hướng dẫn giải
Chọn D
Phương trình hóa học:
OH– + H+→ H2O
0,06 0,06
AlO2– + H+ + H2O → Al(OH)3
0,1 0,1 0,1
Al(OH)3 + 3H+→ Al3+ + 3H2O
0,08 0,24
Ta có:
Ví dụ 7: Cho 100 ml dung dịch HCl 0,5M vào 100 ml dung dịch NaAlO2 1M, phản ứng xong thu được m gam kết tủa. Giá trị của m là
A. 3,90.
B. 7,80.
C. 5,85.
D. 4,68.
Hướng dẫn giải
Chọn A
Ta thấy nên khi đó
Xem thêm các phương trình hóa học hay khác:
Al(OH)3 + NaOH → NaAlO2 + H2O | Al(OH)3 ra NaAlO2
NH3 + AlCl3 + H2O → Al(OH)3 + NH4Cl | NH3 ra NH4Cl




