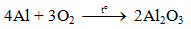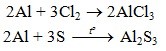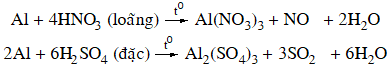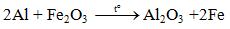Phản ứng Al + HCl → AlCl3 + H2
1. Phương trình phản ứng Al ra AlCl3
2Al + 6HCl → 2AlCl3 + 3H2 ↑
2. Điều kiện phản ứng xảy ra giữa HCl và Al
Nhiệt độ thường
3. Al tác dụng HCl có hiện tượng gì
Al tan dần, có bọt khí không màu xuất hiện.
4. Bản chất của các chất tham gia phản ứng
4.1. Bản chất của Al (Nhôm)
Al tác dụng được với axit như HCl, H2SO4,... loãng.
4.2. Bản chất của HCl (Axit clohidric)
HCl tác dụng với kim loại đứng trước H trong dãy hoạt động hóa học (trừ Pb) tạo thành muối và khí hidro.
5. Tính chất hóa học của Al
Nhôm là kim loại có tính khử mạnh: Al → Al3+ + 3e
5.1. Tác dụng với phi kim
a) Tác dụng với oxi
Al bền trong không khí ở nhiệt độ thường do có lớp màng oxit Al2O3 rất mỏng bảo vệ.
b) Tác dụng với phi kim khác
5.2. Tác dụng với axit
+ Axit không có tính oxi hóa: dung dịch axit HCl, H2SO4 loãng
2Al + 6HCl → 2AlCl3 + 3H2↑
+ Axit có tính oxi hóa mạnh: dung dịch HNO3 loãng, HNO3 đặc, nóng và H2SO4 đặc, nóng.
Nhôm bị thụ động hoá trong dung dịch HNO3 đặc, nguội hoặc H2SO4 đặc nguội.
5.3. Tác dụng với oxit kim loại (Phản ứng nhiệt nhôm)
Lưu ý: Nhôm chỉ khử oxit của các kim loại đứng sau nhôm
5.4. Tác dụng với nước
- Phá bỏ lớp oxit trên bề mặt Al (hoặc tạo thành hỗn hống Al-Hg thì Al sẽ phản ứng với nước ở nhiệt độ thường)
2Al + 6H2O → 2Al(OH)3↓ + 3H2↑
5.5. Tác dụng với dung dịch kiềm
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑
5.6. Tác dụng với dung dịch muối
- Al đẩy được kim loại đứng sau ra khỏi dung dịch muối của chúng:
2Al + 3CuSO4 → Al2(SO4)3 + 3Cu
6. Bài tập vận dụng liên quan
Câu 1. Cho 1,56 gam hỗn hợp gồm Al và Al2O3 phản ứng hết với dung dịch HCl (dư), thu được V lít khí H2 (đktc) và dung dịch X. Nhỏ từ từ dung dịch NH3 đến dư vào dung dịch X thu được kết tủa, lọc hết lượng kết tủa, nung đến khối lượng không đổi thu được 2,04 gam chất rắn. Giá trị của V là
A. 0,448.
B. 0,224.
C. 1,344.
D. 0,672
Lời giải:
nchất rắn = nAl2O3 = 2,04102= 0,02 mol => nAl(chất rắn) = 0,02.2 = 0,04mol
Trong hỗn hợp ban đầu có: Al (x mol), Al2O3 (y mol) => mhh = 27x+102y = 1,56 (1)
Bảo toàn nguyên tố Al
nAl(hỗn hợp) = nAl (chất rắn) = x + 2y=0,04 (2)
(1), (2) => x=0,02, y=0,01
2Al + 6HCl → 2AlCl3 + 3H2
0,02 0,03
=> VH2 = 0,03.22,4= 0,672 lít
Câu 2. Cho 2,7 gam Al phản ứng hoàn toàn với dung dịch HCl dư, thu được V lít khí H2 (đktc). Giá trị của V là
A. 4,48.
B. 2,24.
C. 3,36.
D. 6,72.
Lời giải:
Câu 3. Cho sơ đồ phản ứng : Al → X→ Al2O3→ Al
X có thể là
A. AlCl3.
B. NaAlO2.
C. Al(NO3)3.
D. Al2(SO4)3.
Lời giải:
Câu 4. Dùng hóa chất nào sau đây để phân biệt Zn(NO3)2 và Al(NO3)3?
A. Dung dịch NaOH
B. Dung dịch Ba(OH)2
C. Dung dịch NH3
D. Dung dịch nước vôi trong
Lời giải:
Câu 5. Cho các quặng sau: pirit, thạch cao, mica, apatit, criolit, boxit, dolomit. Số quặng chứa nhôm là:
A.2.
B. 3.
C.4.
D. 5.
Lời giải:
Câu 6. Trong các cặp chất sau đây, cặp chất nào có thể cùng tồn tại trong một dung dịch?
A. AlCl3 và Na2CO3
B. HNO3 và NaHCO3
C. NaAlO2 và KOH
D. NaCl và AgNO3
Lời giải:
Cặp chất nào không phản ứng với nhau có thể cùng tồn tại trong một dung dịch
A- 3Na2CO3 + 2AlCl3 + H2O → 2Al(OH)3 + 6NaCl + 3CO2
B-HNO3 + NaHCO3 → NaNO3 + H2O + CO2
C-Cùng tồn tại
D-NaCl + AgNO3 → NaNO3 + AgCl
Câu 7. Dùng hóa chất nào sau đây để phân biệt Zn(NO3)2 và Al(NO3)3?
A. Dung dịch NaOH
B. Dung dịch Ba(OH)2
C. Dung dịch NH3
D. Dung dịch nước vôi trong
Lời giải:
Khi cho NH3 vào 2 dung dịch cả 2 dung dịch đều xuất hiện kết tủa hiđroxit, nhưng Zn(OH)2 tạo thành có khả năng tạo phức với NH3 nên kết tủa lại tan, còn với Al(OH)3 không tan trong NH3
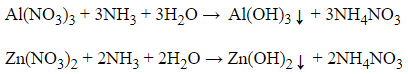
Dung dịch amoniac có khả năng hòa tan hiđroxit hay muối ít tan của một số kim loại (Ag, Cu, Zn), tạo thành các dung dịch phức chất.
Câu 8. Hòa tan hoàn toàn m gam Al vào dung dịch HNO3 loãng, thu được hỗn hợp gồm 0,12 mol khí NO2 và 0,08 mol khí NO (phản ứng không tạo NH4NO3). Giá trị của m là
A. 3,24.
B. 8,1.
C. 6,48.
D. 10,8.
Lời giải:
Bảo toàn số mol electron:
→ 3nAl = nNO2 + 3nNO
→ 3.nAl = 0,12 + 3.0,08
→ nAl = 0,12 mol
→ mAl = 0,12.27 = 3,24g
Xem thêm các phương trình hóa học khác:
Fe3O4 + HCl → FeCl3 + FeCl2 + H2O | Fe3O4 ra FeCl3
AgNO3 + HCl → AgCl + HNO3 l AgNO3 ra AgCl
FeS + HCl → FeCl2 + H2S | FeS ra FeCl2