Phản ứng Ag + HNO3 → AgNO3 + NO↑ + H2O
1. Phương trình phản ứng Ag tác dụng HNO3 loãng
3Ag + 4HNO3 → 3AgNO3 + NO↑ + 2H2O
2. Điều kiện để phản ứng Ag + HNO3 ra NO
Nhiệt độ
3. Cách tiến hành phản ứng Ag tác dụng với HNO3
Cho 1 mẩu nhỏ Ag bỏ vào đáy ống nghiệm, sau đó nhỏ vài giọt dung dịch HNO3 vào ống nghiệm đã đựng sẵn Ag, sau đó đun nhẹ trên đèn cồn.
4. Hiện tượng sau phản ứng Ag tác dụng với HNO3
Chất rắn màu bạc (Ag) tan dần trong dung dịch và sủi bọt khí do khí hóa nâu ngoài không khí Nito oxit (NO) sinh ra.
5. Bản chất của các chất tham gia phản ứng
5.1. Bản chất của Ag (Bạc)
- Trong phản ứng trên Ag là chất khử.
- Ag là kim loại quý kém hoạt động nhưng ion Ag+ có tính oxi hóa mạnh.
- Ag không tác dụng với HCl và H2SO4 loãng, nhưng tác dụng với các axit có tính oxi hóa mạnh, như HNO3 hoặc H2SO4 đặc, nóng.
5.2. Bản chất của HNO3 (Axit sunfuric)
- Trong phản ứng trên HNO3 là chất oxi hoá.
- Đây là một monoaxit mạnh, có tính oxi hóa mạnh có thể nitrat hóa nhiều hợp chất vô cơ.
6. Một số tính chất về Bạc
6.1. Tính chất vật lí
Bạc có tính mềm, dẻo (dễ kéo sợi và dát mỏng), màu trắng, dẫn điện và dẫn nhiệt tốt nhất trong các kim loại.
Bạc là kim loại nặng có khối lượng riêng 10,49 g·cm−3, nhiệt độ nóng chảy là 960,50C.
6.2. Tính chất hóa học
Kém hoạt động (kim loại quý), nhưng ion Ag+ có tính oxi hóa mạnh, bạc có thế điện cực chuẩn (E0Ag+/Ag= + 0,80V).
a. Tác dụng với phi kim
Bạc không bị oxi hóa trong không khí dù ở nhiệt độ cao.
Tác dụng với ozon
2Ag + O3→ Ag2O + O2
b. Tác dụng với axit
Bạc không tác dụng với HCl và H2SO4 loãng, nhưng tác dụng với các axit có tính oxi hóa mạnh, như HNO3 hoặc H2SO4 đặc, nóng.
3Ag + 4HNO3 (loãng) → 3AgNO3 + NO + 2H2O
2Ag + 2H2SO4 (đặc, nóng) → Ag2SO4 + SO2 + 2H2O
c. Tác dụng với các chất khác
Bạc có màu đen khi tiếp xúc với không khí hoặc nước có mặt hidro sunfua:
4Ag + 2H2S + O2 (kk) → 2Ag2S + 2H2O
Bạc tác dụng được với axit HF khi có mặt của oxi già:
2Ag + 2HF (đặc) + H2O2 → 2AgF + 2H2O
2Ag + 4KCN (đặc) + H2O2 → 2K[Ag(CN)2] + 2KOH
6.3. Trạng thái tự nhiên
Bạc trong tự nhiên là hỗn hợp của hai đồng vị ổn định Ag107 và Ag109 với Ag107 là phổ biến nhất (51,839%).
Bạc được tìm thấy ở dạng tự nhiên, liên kết với lưu huỳnh, asen, antimoan, hay clo trong các loại khoáng chất như argentit (Ag2S) và silver horn (AgCl). Các nguồn cơ bản của bạc là các khoáng chất chứa đồng, đồng-niken, vàng, chì và chì-kẽm có ở Canada, Mexico, Peru, Úc và Mỹ.
6.4. Ứng dụng của bạc
Ứng dụng cơ bản nhất của bạc là như một kim loại quý và các muối halôgen. Đặc biệt bạc nitrat được sử dụng rộng rãi trong phim ảnh.
Các ứng dụng khác còn có:
Các sản phẩm điện và điện tử, trong đó cần có tính dẫn điện cao của bạc, thậm chí ngay cả khi bị xỉn.
Các loại gương cần tính phản xạ cao của bạc đối với ánh sáng được làm từ bạc như là vật liệu phản xạ ánh sáng. Các loại gương phổ biến có mặt sau được mạ nhôm.
Kim loại này được chọn vì vẻ đẹp của nó trong sản xuất đồ trang sức và đồ bạc.
Bạc được sử dụng để làm que hàn, công tắc điện và các loại pin dung tích lớn như pin bạc-kẽm hay bạc-cadmi.
7. Bài tập vận dụng liên quan
Câu 1. Phát biểu nào sau đây không đúng?
A. Kim loại cesi được dùng để làm tế bào quang điện
B. Kim loại crom được dùng để làm dao cát kính.
C. Kim loai bạc dược dùng để làm dây dẫn điện trong gia đình
D. Kim loại chì được dùng để chế tạo điện cực trong acquy.
Lời giải:
Câu 2. Cho các kim loại sau: Li, Mg, Al, Zn, Fe, Ni. Có bao nhiêu kim loại tác dụng với HCl và Cl2 thu được cùng một muối ?
A. 6
B. 3
C. 4
D. 5
Lời giải:
Các kim loại tác dụng với HCl và Cl2 cho cùng một muối là: Li; Mg; Al; Zn; Ni.
Li + HCl → LiCl + H2
Mg + 2HCl → MgCl2 + H2
2Al + 6HCl → 2AlCl3 + 3H2
Zn + 2HCl → ZnCl2 + H2
Ni + 2HCl → NiCl2 + H2
Li + Cl2 → LiCl
Mg + Cl2 → MgCl2
2Al + 3Cl2 → 2AlCl3
Zn + Cl2 → ZnCl2
Ni + Cl2 → NiCl2
Câu 3. Kim loại nào dưới đây có khả năng dẫn điện mạnh nhất
A. Au
B. Al
C. Fe
D. Ag
Lời giải:
Câu 4. Những kim loại nào sau đây không tác dụng được với dd HNO3 đặc, nguội
A. Fe, Al, Cr
B. Cu, Ag, Cr
C. Al, Fe, Cu
D. Mn, Ni, Al
Lời giải:
Câu 5. Hòa tan hoàn toàn hh X gồm 8,1 gam Al và 29,25 gam Zn bằng dd HNO3 12,6% (vừa đủ) thu được V lit N2O (đktc, khí duy nhất) và dd Y chứa 154,95 gam muối tan. Giá trị của V là:
A. 3,36
B. 5,04
C. 4,48
D. 6,72
Lời giải:
mAl(NO3)3 = 8,1.21327 = 63,9 gam
mZn(NO3)3 = 29,25.18965 = 85,05 gam
my = mAl(NO3)3 + mZn(NO3)3 + mNH4NO3
=> mNH4NO3 = 6 gam => nNH4NO3 = 0,075 mol
nN2O = 0,3.3+0,45.2-0,075.88= 0,15 mol
=> V = 0,15.22,4 = 3,36 lít
Câu 6. Nguyên tử kim loại khi tham gia phản ứng hoá học có tính chất nào sau đây ?
A. Nhường electron và tạo thành ion âm.
B. Nhường electron và tạo thành ion dương.
C. Nhận electron để trở thành ion âm.
D. Nhận electron để trở thành ion dương.
Lời giải:
Nguyên tử kim loại khi tham gia phản ứng hóa học đóng vai trò chất khử → Nhường electron và tạo thành ion dương.
Câu 7. Những tính chất vật lí chung của kim loại (dẫn điện, dẫn nhiệt, dẻo, ánh kim) gây nên chủ yếu bởi
A. cấu tạo mạng tinh thể của kim loại.
B. khối lượng riêng của kim loại.
C. các electron độc thân trong tinh thể kim loại
D. các electron tự do trong tinh thể kim loại.
Những tính chất vật lí chung của kim loại (dẫn điện, dẫn nhiệt, dẻo, ánh kim) gây nên chủ yếu bởi các e tự do trong tinh thể kim loại.
Câu 8. Một thanh kim loại M hóa trị 2 được nhúng vào trong 1 lít dung dịch CuSO4 0,5M. Sau khi lấy thanh M ra và cân lại ,thấy khối lượng thanh tăng 1,6 gam, nồng độ CuSO4 còn 0,3M. Hãy xác định kim loại M?
A. Fe
B. Mg
C. Zn
D. Pb
Lời giải:
M + Cu2+ → M2+ + Cu
Số mol Cu2+ phản ứng là: 1(0,5 – 0,3) = 0,2 mol
Độ tăng khối lượng của thanh kim loaị M:
M = mCu – mM tan = 0,2. (64 – M) = 1,6
Suy ra: M = 56 là Fe
Câu 9. Ngâm Cu dư vào dung dịch AgNO3 thu được dung dịch X, sau đó ngâm Fe dư vào dung dịch X thu được dung dịch Y. dung dịch Y gồm:
A. Fe(NO3)2
B. Fe(NO3)2, Cu(NO3)2, AgNO3
C. Fe(NO3)2, Cu(NO3)2
D. Fe(NO3)3
Lời giải:
Ngâm Cu dư vào dung dịch AgNO3, Ag là kim loại yếu sẽ bị đẩy hết ra khỏi muối, muối mới là Cu(NO3)2 (dung dịch X).
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
Ngâm Fe dư vào dung dịch X, Cu yếu hơn nên bị đẩy hết ra khỏi muối tạo muối mới là Fe(NO3)2.
Fe + Cu(NO3)2 → Fe(NO3)2 + Cu
Câu 10. Để loại bỏ kim loại Cu ra khỏi hỗn hợp bột gồm Ag và Cu, người ta ngâm hỗn hợp kim loại trên vào lượng dư dung dịch
A. AgNO3.
B. Zn(NO3)2.
C. Cu(NO3)2.
D. Fe(NO3)2.
Lời giải:
Ta ngâm vào lượng dư dung dịch AgNO3 vì Cu phản ứng với AgNO3 tạo thành dung dịch muối và đẩy kim loại Ag ra khỏi muối.
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag.
Câu 11. Cặp chất không xảy ra phản ứng là
A. Fe + Cu(NO3)2.
B. Fe + AgNO3.
C. Zn + Fe(NO3)2.
D. Fe + Zn(NO3)2.
Lời giải:
Fe đứng sau Zn trong dãy điện hóa → Fe không thể khử ion Zn2+.
Câu 12. Ngâm đinh sắt sạch trong 500 ml dd CuSO4. Sau phản ứng kết thúc lấy đinh sắt ra rửa nhẹ và làm khô thấy khối lượng đinh sắt tăng 8 gam. Nồng độ CuSO4 ban đầu là:
A. 2 M
B. 0,5 M
C. 5 M
D. 0,2 M
Lời giải:
Gọi số mol Fe phản ứng là x mol.
Fe + CuSO4 → Cu + FeSO4
x → x → x
→ mtăng = 64x – 56x = 8 → x = 1 mol
→ nCuSO4 = x = 1 mol → CM(CuSO4) = 10,5= 2M
Câu 13. Nung nóng một hỗn hợp gồm Al và 16 gam Fe2O3 (trong điều kiện không có không khí) đến khi phản ứng xảy ra hoàn toàn, thu được hỗn hợp rắn X. Cho X tác dụng vừa đủ với V ml dung dịch KOH 1M sinh ra 3,36 lít H2 (đktc). Giá trị của V là
A. 150.
B. 100.
C. 300
D. 200.
Lời giải:
Phản ứng : 2Al + Fe2O3Al2O3 + 2Fe
Vì chất rắn sau phản ứng khí cho vào dung dịch KOH tạo khí H2 => Al dư
=> Fe2O3 phản ứng hết. nFe2O3 = 16160= 0,1 mol
Chất rắn sau phản ứng gồm: Al ; 0,1 mol Al2O3; 0,2 mol Fe
nH2 = 3,3622,4 = 0,15 mol
Phương trình phản ứng:
Al + KOH + H2O → KAlO2 + 32H2
Al2O3 + 2KOH → 2KAlO2 + H2O
=> nKOH = 23nH2 + 2nAl2O3 =23.0,15 + 2.0,1 = 0,3 mol
=> Vdd KOH = nKOHCM= 0,31 = 0,3 lit = 300 ml
Câu 14. Nung hỗn hợp gồm 21,6 gam Al và 32,0 gam Fe2O3 (trong điều kiện không có không khí), sau khi phản ứng xảy ra hoàn toàn thu được chất rắn Y . khối lượng kim loại trong Y là:
A. 33,2 gam
B. 22,4 gam
C. 11,2 gam
D. 16,6 gam
Lời giải:
Ta có: nAl = 21,627 = 0,8 mol
nFe2O3= 32160 = 0,2 mol
Phương trình phản ứng hóa học
2Al + Fe2O3 → Al2O3 + 2Fe
0,4 ← 0,2 → 0,4
=> nAl dư = 0,8 – 0,4 = 0,4 mol
=> sau phản ứng trong Y có 2 mol Al dư và 0,2 mol Fe
=> m kl trong Y = 0,4.27 + 0,4 . 56 = 33,2 (g)
Câu 15. Cho m gam Al tác dụng hoàn toàn với HNO3 loãng, sau phản ứng thu được 3,36 lit N2O (đktc) là sản phầm khử duy nhất. Khối lượng muối thu được sau phản ứng là
A. 45,6 gam
B. 42,6 gam
C. 85,2 gam
D. 56,7 gam
Lời giải:
nN2O = V22,4 = 0,15 mol
Al0 → Al+3 + 3e
x → 3x
2N+5 + 8e → N2+1 (N2O)
1,2 ← 0,15
Bảo toàn e => 3x = 1,2 => x = 0,4 mol
nAl(NO3)3 = nAl= 0,4 mol
=> mmuối = 0,4.213 = 85,2 gam
Câu 16. Tiến hành các thí nghiệm sau:
(1) Sục khí H2S vào dung dịch AgNO3
(2) Sục khí H2S vào dung dịch CuSO4
(3) Sục khí CO2 (dư) vào dung dịch Na2SiO3
(4) Sục khí SO2 vào dung dịch H2S
(5) Nhỏ từ từ dung dịch NH3 đến dư vào dung dịch ZnSO4
(6) Nhỏ từ từ dung dịch Ba(OH)2 đến dư vào dung dịch Al2(SO4)3
Sau khi các phản ứng xảy ra hoàn toàn, số thí nghiệm thu được kết tủa là;
A. 5
B. 4
C. 3
D. 6
Lời giải:
Các thi nghiệm thu được kết tủa là:
(2) Sục khí H2S vào dung dịch CuSO4
(CuS không tan trong axit)
(3) Sục khí CO2(dư) vào dung dịch Na2SiO3
(H2SiO3)
(4) Sục khí SO2 vào dung dịch H2S
( S )
(6) Nhỏ từ từ dung dịch Ba(OH)2 đến dư vào dung dịch Al2(SO4)3
( BaSO4)
Câu 17. Các đồ vật bằng bạc để lâu trong không khí thường bị xỉn màu đen. Nguyên nhân gây ra hiện tượng này là do:
A. Bạc tác dụng với O2 trong không khí.
B. Bạc tác dụng với hơi nước.
C. Bạc tác dụng đồng thời với khí O2 và H2S trong không khí.
D. Bạc tác dụng với khí CO2.
Lời giải:
Trong không khí có chứa các chất O2, H2S, hơi nước… Vì vậy Ag tác dụng đồng thời với O2 và H2S tạo muối Ag2S màu đen gây ra hiện tượng xỉn màu.
4Ag + O2 + 2H2S → 2Ag2S + 2H2O
Câu 18. Hòa tan hoàn toàn m gam Ag trong lượng dư HNO3 loãng thu được 4,48 lít khí không màu hóa nâu trong không khí (đktc, sản phẩm khử duy nhất). Giá trị của m là
A. 10,8.
B. 21,8.
C. 32,4.
D. 64,8
Lời giải:
Khí không màu hóa nâu trong không khí là NO
Phản ứng xảy ra:
3Ag+4HNO3→3AgNO3+NO+2H2O
Ta có:
nNO=4,4822,4=0,2 mol
→nAg=3nNO=0,2.3=0,6 mol
→m=mAg=0,6.108=64,8 gam
Câu 19. Hòa tan hết 10,8 gam Ag vào dung dịch HNO3 đặc, đun nóng thu được khí X (sản phẩm khử duy nhất). Hấp thụ toàn bộ khí X vào 200ml dung dịch KOH 1M thu được dung dịch Y. Cô cạn dung dịch Y rồi nung đến khối lượng không đổi thì khối lượng chất còn lại là (Cho Ag = 108, N = 14, O = 16, K = 39)
A. 19,94 gam
B. 8,5 gam
C. 14,1 gam
D. 19,14 gam
Lời giải:
Ag tác dụng với dung dịch HNO3 đặc, nóng thì sản phẩm khử là NO2
Ag + 2HNO3 → AgNO3 + NO2 + H2O
0,1 0,1
2NO2 + 2KOH → KNO2 + KNO3 + H2O
0,1 0,1 0,05 0,05
Sản phẩm gồm: KNO2, KNO3, KOH dư. Khi nung thì:
2KNO3 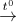 2KNO2 + O2
2KNO2 + O2
0,05 0,05
Ta thu được: KOH dư: 0,1 mol và KNO2: 0,1 mol
m = 56.0,1 + 85.0,1 = 14,1 (gam)
Xem thêm các phương trình hóa học liên quan khác:
Ag + HNO3 → AgNO3 + NO2 + H2O | Ag ra AgNO3
AgNO3 → Ag + NO2 + O2 l AgNO3 ra Ag
HCHO + AgNO3 + NH3 + H2O → Ag + NH4NO3 + (NH4)2CO3 | HCHO ra NH4NO3
AgNO3 + H2O + NH3 + HCOOH → (NH4)2CO3 + Ag + NH4NO3 | AgNO3 ra Ag




