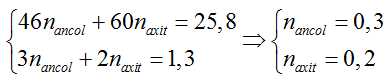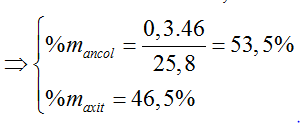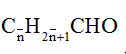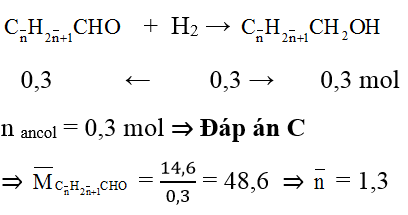Bài tập về Anđehit - Xeton
Kiến thức cần nhớ
Anđehit
I. Định nghĩa, phân loại, danh pháp
1. Định nghĩa
- Anđehit là những hợp chất hữu cơ mà phân tử có nhóm – CH = O (hay – CHO) liên kết trực tiếp với nguyên tử cacbon hoặc nguyên tử hiđro.
- Nhóm chức – CHO là nhóm chức anđehit.
- Ví dụ:
HCHO; CH3CHO; OHC – CHO…
2. Phân loại
- Dựa theo đặc điểm cấu tạo của gốc hiđrocacbon, anđehit được chia thành:
+ Anđehit no;
+ Anđehit không no;
+ Anđehit thơm.
- Dựa theo số nhóm -CHO trong phân tử, anđehit được chia thành:
+ Anđehit đơn chức
+ Anđehit đa chức
Chú ý:
Anđehit no, mạch hở, đơn chức có công thức cấu tạo thu gọn CxH2x+1CHO (x ≥ 0) hay công thức phân tử chung CnH2nO (n ≥ 1).
3. Danh pháp
a) Tên thông thường
- Một số anđehit có tên thông thường.
- Tên thông thường = anđehit + tên axit tương ứng
- Ví dụ:
HCHO: anđehit fomic
CH3CHO: anđehit axetic
b) Tên thay thế của các anđehit no, đơn chức, mạch hở:
- Chọn mạch chính của phân tử anđehit là mạch cacbon dài nhất có chứa nhóm -CHO.
- Đánh số thứ tự C trên mạch chính, bắt đầu từ nhóm – CHO.
- Tên thay thế = tên hiđrocacbon tương ứng với mạch chính + al
- Ví dụ:
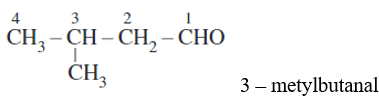
II. Đặc điểm cấu tạo và tính chất vật lý
1. Đặc điểm cấu tạo
Trong nhóm – CHO, liên kết đôi C = O gồm một liên kết σ bền và một liên kết π kém bền hơn, tương tự liên kết C = C trong phân tử anken, do đó anđehit có một số tính chất giống anken.
2. Tính chất vật lý
- Ở điều kiện thường, các anđehit đầu dãy đồng đẳng là chất khí và tan tốt trong nước. Các anđehit tiếp theo là chất lỏng hoặc rắn.
- Độ tan trong nước của các anđehit giảm dần theo chiều tăng của phân tử khối.
III. Tính chất hóa học
1. Phản ứng cộng hiđro
Ví dụ:
CH3 – CH = O + H2 CH3 – CH2 – OH
Phản ứng tổng quát:
RCHO + H2 RCH2OH
⇒ Trong phản ứng này anđehit đóng vai trò là chất oxi hóa.
2. Phản ứng oxi hóa không hoàn toàn
- Phản ứng tráng gương
Ví dụ:
CH3CHO + 2AgNO3 + H2O + 3NH3 CH3COONH4 + 2NH4NO3 + 2Ag↓
Phản ứng tổng quát:
RCHO + 2AgNO3 + H2O + 3NH3 RCOONH4 + 2NH4NO3 + 2Ag↓
- Phản ứng tạo thành axit
2RCHO + O2 2RCOOH
⇒ Trong các phản ứng trên anđehit đóng vai trò là chất khử.
3. Phản ứng oxi hóa hoàn toàn
Phản ứng tổng quát khi đốt cháy hoàn toàn anđehit no, đơn chức, mạch hở:
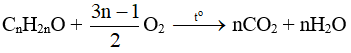
IV: Điều chế
1. Từ ancol
Oxi hóa ancol bậc I, được anđehit tương ứng:
RCH2OH + CuO RCHO + Cu + H2O
2. Từ hiđrocacbon
- Oxi hóa metan có xúc tác thu được anđehit fomic
CH4 + O2 HCHO + H2O
- Oxi hóa không hoàn toàn etilen là phương pháp hiện đại để sản xuất anđehit axetic
2CH2= CH2 + O2 2CH3CHO
V: Ứng dụng
- Fomanđehit được dùng làm nguyên liệu sản xuất nhựa phenol – fomanđehit và nhựa ure – fomanđehit.
- Dung dịch nước của fomanđehit được dùng làm chất tẩy uế, ngâm mẫu động vật làm tiêu bản …
- Anđehit axetic được dùng làm nguyên liệu sản xuất axit axetic.
- Nhiều anđehit có nguồn gốc thiên nhiên được dùng làm hương liệu cho công nghiệp thực phẩm, mĩ phẩm …
Xeton
I. Định nghĩa
- Xeton là những hợp chất hữu cơ mà phân tử có nhóm ![]() liên kết trực tiếp với hai nguyên tử cacbon.
liên kết trực tiếp với hai nguyên tử cacbon.
Ví dụ:
CH3 – CO – CH3: đimetyl xeton.
II. Tính chất hóa học
- Giống anđehit, xeton cộng hiđro tạo thành ancol. Tổng quát:
R – CO – R1 + H2 R – CH(OH) – R1
Ví dụ:
CH3 – CO – CH3 + H2 CH3 – CH(OH) – CH3
- Khác với anđehit, xeton không tham gia phản ứng tráng bạc.
III. Điều chế
1. Từ ancol
Oxi hóa không hoàn toàn ancol bậc II được xeton. Ví dụ:
CH3 – CH(OH) – CH3 + CuO CH3 – CO – CH3 + Cu + H2O
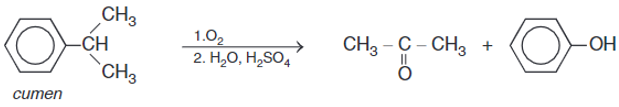
2. Từ hiđrocacbon
Oxi hóa không hoàn toàn cumen được axeton và phenol theo sơ đồ:
Các dạng bài tập về Anđehit – Xeton
Dạng 1: Đồng phân, danh pháp, tính chất vật lí, ứng dụng
Dạng 2: Tính chất hóa học, nhận biết, điều chế
Dạng 3: Bài toán định lượng, xác định công thức phân tử, công thức cấu tạo
Bài toán 1: Phản ứng tráng gương
Phương pháp giải
+ Anđehit no đơn chức cho 2Ag, trừ HCHO cho 4Ag.
R – CH = O → 2Ag↓ (R ≠ H)
H – CH = O → 4Ag↓
Bài toán 2: Phản ứng đốt cháy
Phương pháp giải
Nếu đốt cháy chất hữu cơ (chứa C, H, O) thu được số mol nước bằng số mol khí cacbonic thì nó có thể là:
+ Anđehit no đơn chức, mạch hở.
+ Ancol không no, chứa một liên kết đôi.
Công thức tổng quát: CnH2nO.
Bài tập tự luyện
1. Bài tập vận dụng
Câu 1: Trung hòa 3,88 gam hỗn hợp X gồm hai axit cacboxylic no, đơn chức, mạch hở bằng dung dịch NaOH, cô cạn toàn bộ dung dịch sau phản ứng thu được 5,2 gam muối khan. Nếu đốt cháy hoàn toàn 3,88 gam X thì thể tích oxi (đktc) cần dùng là
A. 4,48 lít.
B. 3,36 lít.
C. 2,24 lít.
D. 1,12 lít.
Hướng dẫn giải:
Đặt công thức chung của 2 axit là: CnH2nO2
RCOOH → RCOONa
Cứ 1 mol axit + NaOH → 1 mol muối tăng 22g
⇒ naxit = (5,2-3,88)/22 = 0,06 mol
Maxit = 3,88 : 0,06 = 64,6 ⇒ 14n + 32 = 64,6 ⇒ n = 7/3
CnH2nO2 + (3n-2)/2O2 → nCO2 + nH2O
0,06 0,06. (3n-2)/2 (mol)
⇒ nO2 = 0,15 mol ⇒ VO2 = 3,36 lít
⇒ Đáp án B
Câu 2: Đốt cháy hoàn toàn 1 andehit no, đơn chức, mạch hở X cần 17,92 lít khí oxi (đktc). Hấp thụ hết sản phẩm cháy vào dung dịch nước vôi trong dư được 60gam kết tủa. Công thức phân tử của X là
A. CH2O.
B. C2H4O.
C. C3H6O.
D. C4H8O.
Hướng dẫn giải:
nCO2 = nCaCO3 = 0,6 mol; nO2 = 0,8 mol
Gọi anđehit no đơn chức mạch hở X là: CnH2nO
CnH2nO + (3n-1)/2O2 → nCO2 + nH2O
0,8 0,6
Ta có: 0,8.n = 0,6. (3n-1)/2 ⇒ n = 3
⇒ X là: C3H6O ⇒ Đáp án C
Câu 3: Một hỗn hợp đẳng mol gồm một axit cacboxylic no đơn chức và một ancol no đơn chức. Chia hỗn hợp làm hai phần bằng nhau. Phần 1 đem đốt cháy thu được 0,2 mol CO2 và 0,25 mol H2O. Phần 2 đem thực hiện phản ứng este hóa, phản ứng xong đem loại nước rồi đốt cháy thu được 0,2 mol CO2 và 0,22 mol H2O. Hiệu suất của phản ứng este hóa là
A. 40%
B. 45%
C. 50%
D. 60%
Hướng dẫn giải:
Phần 1:
Đốt cháy ancol no đơn chức: nancol = nH2O – nCO2
Đốt cháy axit no đơn chức: nCO2 = nH2O
⇒ Đốt cháy phần 1: nancol = nH2O – nCO2 = 0,05 mol
Phần 2:
Ta thấy, lượng H2O loại đi chính là số mol este tạo thành
=> neste = 0,25 - 0,22 = 0,03 mol
=> H% = 0,3/0,5 . 100% = 60%
⇒ Đáp án D
Câu 4: Khi đun nóng 25,8 gam hỗn hợp ancol etylic và axit axetic có H2SO4 đặc làm xúc tác thu được 14,08 gam este. Nếu đốt cháy hoàn toàn lượng hỗn hợp đó thu được 23,4 ml nước. Thành phần % hỗn hợp ban đầu và hiệu suất của phản ứng este hóa lần lượt là
A. 53,5% C2H5OH; 46,5% CH3COOH và hiệu suất 80%.
B. 55,3% C2H5OH; 44,7% CH3COOH và hiệu suất 80%.
C. 60,0% C2H5OH; 40,0% CH3COOH và hiệu suất 75%.
D. 45,0% C2H5OH; 55,0% CH3COOH và hiệu suất 60%.
Hướng dẫn giải:
Hiệu suất tính theo axit
C2H5OH + CH3COOH → CH3COOC2H5 + H2O
0,2 ← 0,2 → 0,2 (mol)
neste = 0,16 => H% = 0,16/0,2 .100% = 80%
⇒ Đáp án A
Câu 5: Cho 5,76 gam axit hữu cơ X đơn chức, mạch hở tác dụng hết với CaCO3 thu được 7,28 gam muối của axit hữu cơ. Công thức cấu tạo thu gọn của X là
A. CH2=CH - COOH.
B. CH3COOH.
C. HC C - COOH.
D. CH3 - CH2 - COOH.
Hướng dẫn giải:
Đặt công thức của X là: RCOOH
RCOOH → (RCOO)2Ca
R + 45 → 2R + 128 (g)
5,76 → 7,28
⇒ 5,76.(2R + 128) = 7,28.(R+45)
⇒ R = 27 ( C2H3-)⇒ X là: CH2=CH – COOH
⇒ Đáp án A
Câu 6: A và B là 2 axit cacboxylic đơn chức. Trộn 1,2 gam A với 5,18 gam B được hỗn hợp X. Để trung hòa hết X cần 90 ml dung dịch NaOH 1M. A, B lần lượt là
A. Axit acrylic, axit axetic.
B. Axit axetic, axit propionic.
C. Axit acrylic, axit propionic.
D. Axit axetic, axit acrylic.
Hướng dẫn giải:
maxit = 1,2 + 5,18 = 6,38g; nNaOH = 0,09mol
Gọi công thức chung của 2 axit là RCOOH
nRCOOH = nNaOH = 0,09 mol
⇒ MRCOOH = 6,38/0,09 = 70,8 ⇒ R = 25,8
⇒ A hoặc B phải là CH3COOH
+ Nếu A là CH3COOH ⇒ nA = 1,2 : 60 = 0,02 mol
⇒ nB = 0,09 – 0,02 = 0,07 mol
MB = 5,18 : 0,07 = 74 ⇒ B là: C2H5COOH
+ Nếu B là CH3COOH ⇒ A không có giá trị
⇒ Đáp án B
Câu 7: Cho 2,46 gam hỗn hợp X gồm HCOOH, CH3COOH, C6H5OH tác dụng vừa đủ với 40 ml dung dịch NaOH 1M. Tổng khối lượng muối khan thu được sau khi phản ứng là:
A. 3,52 gam.
B. 6,45 gam.
C. 8,42 gam.
D. 3,34 gam.
Hướng dẫn giải:
Hỗn hợp X đều tác dụng với NaOH → muối + H2O
nNaOH = nH2O
Áp dụng định luật bảo toàn khối lượng ta có:
mmuối = mX + mNaOH – mH2O
mmuối = 2,46 + 0,04.40 – 0,04.18 = 3,34g
⇒ Đáp án D
Câu 8: Cho 1,72 gam hỗn hợp anđehit acrylic và anđehit axetic tham gia phản ứng cộng vừa đủ 1,12 lít H2(đktc). Cho thêm 0,696 gam anđehit B là đồng đẳng của anđehit fomic vào 1,72 gam hỗn hợp 2 anđehit trên rồi cho hỗn hợp thu được tham gia phản ứng tráng bạc hoàn toàn được 10,152 gam Ag. Công thức cấu tạo của B là:
A. CH3CH2CHO.
B. C4H9CHO.
C. CH3CH(CH3)CHO.
D. CH3CH2CH2CHO.
Hướng dẫn giải:
CH2=CH-CHO ( x mol); CH3-CHO (y mol)
⇒ 56x + 44y = 1,72g
nH2 = 2x + y = 0,05 mol
⇒ x = 0,015 mol; y = 0,02 mol
Ta có: nAg = 0,094 mol = 2x + 2y + 2 nB
⇒ nB = 0,012 mol; MB = 0,696/0,012= 58
Câu 9: Cho 14,6 gam hỗn hợp 2 anđehit đơn chức, no kế tiếp tác dụng hết với H2 tạo 15,2 gam hỗn hợp 2 ancol.
a. Tổng số mol 2 ancol là
A. 0,2 mol.
B. 0,4 mol.
C. 0,3 mol.
D. 0,5 mol.
b. Khối lượng anđehit có KLPT lớn hơn là
A. 6 gam.
B. 10,44 gam.
C. 5,8 gam.
D. 8,8 gam.
Hướng dẫn giải:
Áp dụng định luật bảo toàn khối lượng: mH2 = mancol – manđehit = 0,6g
nH2 = 0,3 mol
Gọi công thức chung của 2 anđehit no đơn chức là:
⇒ 2 anđehit là: CH3CHO (x mol) và C2H5CHO (y mol)
Dựa vào phương trình tổng số mol và tổng khối lượng ⇒ x = 0,2; y = 0,1
mC2H5CHO = 0,1.58= 5,8g ⇒ Đáp án C
Câu 10: Hiđro hóa hoàn toàn 2,9 gam một anđehit no A được 3,1 gam ancol. A có công thức phân tử là
A. CH2O.
B. C2H4O.
C. C3H6O.
D. C2H2O2.
Hướng dẫn giải:
Áp dụng định luật bảo toàn khối lượng:
mH2 = mancol – manđehit = 3,1 – 2,9 = 0,2g
nH2 = 0,1 mol
R(CHO)n + nH2 → R(CH2OH)n
0,1/n ← 0,1 (mol)
Ta có: manđehit = 0,1/n . (R + 29n) = 2,9 ⇒ R = 0
⇒ Anđehit là: (CHO)2 ⇒ Đáp án D
2. Bài tập tự luyện có hướng dẫn
(Xem thêm trong file dưới)
Xem thêm các dạng bài tập và câu hỏi liên quan khác
500 Bài tập Hóa 11 Chương 6: Hiđrocacbon không no (có đáp án)
500 Bài tập Hóa 11 Chương 5: Hiđrocacbon no (có đáp án)
500 Bài tập Hóa 11 Chương 2: Nitơ - Photpho (có đáp án)