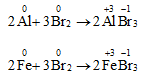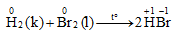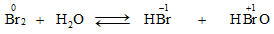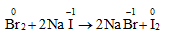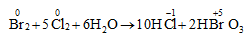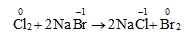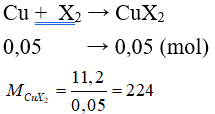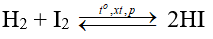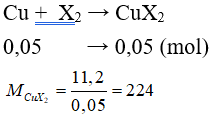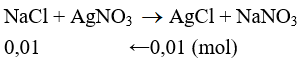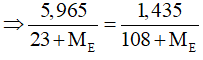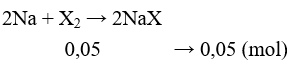Bài tập về Brom
I. Lý thuyết và phương pháp giải
1. Định nghĩa
- Brom là một phi kim hay còn được gọi là một halogen
- Kí hiệu: Br
- Cấu hình electron:1s22s22p63s23p64s24p5 hay [Ar]4s24p5
- Số hiệu nguyên tử: Z = 35
- Khối lượng nguyên tử: 80
- Vị trí trong bảng tuần hoàn:
+ Ô, nhóm: ô số 35, nhóm VIIA
+ Chu kì: 4
- Đồng vị: Brom có 2 đồng vị bền là 7935Br và 8135Br
- Độ âm điện: 2,96
2. Tính chất vật lí & nhận biết
- Ở điều kiện bình thường, brom là chất lỏng, dễ bay hơi, có màu nâu đỏ.
- Brom ít tan trong nước, tan nhiều trong dung môi hữu cơ như benzen hay cacbon tetraclorua.
- Brom và hơi brom độc, rơi vào da có thể gây bỏng nặng.
3. Tính chất hóa học
Nhận xét: Brom là chất có tính oxi hóa mạnh nhưng kém clo.
a. Tác dụng với kim loại
Brom oxi hóa được hầu hết kim loại, trừ Au, Pt
b. Tác dụng với hiđro
Brom tác dụng với hiđro khi đun nóng (không gây nổ), phản ứng tỏa nhiệt nhưng ít hơn so với phản ứng của clo.
c. Tác dụng với nước và với dung dịch kiềm
* Brom phản ứng với nước tương tự như clo nhưng kém hơn
* Khi tác dụng với kiềm:
d. Tác dụng với muối của các halogen khác
* Halogen mạnh đẩy halogen yếu hơn ra khỏi dung dịch muối
5. Tác dụng với clo trong nước
4. Điều chế và ứng dụng
a. Điều chế
* Việc điều chế brom dựa vào sự oxi hóa ion Br- , chất oxi hóa là clo
b. Ứng dụng
- Chế tạo dược phẩm, phẩm nhuộm
- Chế tạo AgBr là chất nhạy cảm với ánh sáng để tráng lên phim ảnh
5. Phương pháp giải bài tập
+ Bước 1: Tính số mol các chất đề bài đã cho số liệu và viết phương trình phản ứng hóa học xảy ra.
+ Bước 2: Tính toán luôn theo phương trình phản ứng hóa học hoặc đặt ẩn nếu đề bài là hỗn hợp.
+ Bước 3: Lập phương trình toán học và giải phương trình Số mol các chất cần tìm.
+ Bước 4: Tính toán theo yêu cầu đề bài.
Lưu ý: Trong một hỗn hợp mà có nhiều phản ứng xảy ra thì phản ứng trung hoà được ưu tiên xảy ra trước.
II. Ví dụ minh họa
Ví dụ 1: Dẫn hỗn hợp etilen và metan có thể tích 2,24 lít đi qua dung dịch brom dư thấy còn 1,12 lít khí bay ra. Khối lượng brom tham gia phản ứng là:
A. 16g
B. 24g
C. 32g
D. 8g
Lời giải chi tiết
Khí bay ra là metan
→ Vmetan = 1,12 lít
→ Vetilen = 2,24 – 1,12 = 1,12 lít
→netilen=1,1222,4=0,05 mol
Phương trình hóa học :
C2H4+Br2→C2H4Br20,05→0,05
→mBr2=0,05.160=8g
Ví dụ 2: Dẫn từ từ 2,24 lít hỗn hợp khí gồm etilen và metan đi qua bình đựng dung dịch brom dư, thấy có 1,12 lít một chất khí thoát ra khỏi bình đựng dung dịch brom. Biết thể tích các khí đo ở điều kiện tiêu chuẩn. Thành phần phần trăm về thể tích các khí trong hỗn hợp là:
A. 60% và 40%
B. 50% và 50%
C. 55% và 45%
D. 30% và 30%
Lời giải chi tiết
Khí bay ra là metan
→ Vmetan = 1,12 lít
→%Vmetan=1,1222,4.100%=50%
→%Vetilen=100%−50%=50%
III. Bài tập tự luyện
Câu 1: Trong phản ứng hóa học sau: SO2 + Br2 + 2H2O → H2SO4 + 2HBr. Brom đóng vai trò là
A. chất khử.
B. vừa là chất oxi hóa vừa là chất khử.
C. chất oxi hóa.
D. không là chất oxi hóa không là chất khử.
Lời giải:
Đáp án C
Câu 2: Chất khí có thể làm mất màu nước brom ở điều kiện thường là
A. SO2. B. CO2.
C. O2. D. HCl.
Lời giải:
Đáp án A.
Phản ứng xảy ra: SO2 + Br2 + 2H2O → H2SO4 + 2HBr
Trước phản ứng dung dịch brom có màu vàng nâu, các dung dịch thu được sau phản ứng không màu.
Câu 3: Cho 1,12 lít (đktc) halogen X2 tác dụng vừa đủ với đồng kim loại thu được 11,2 gam CuX2. Nguyên tố halogen là
A. Flo. B. Clo.
C. Brom. D. Iot.
Lời giải:
Đáp án C
⇒ 64 + 2.MX = 224 ⇒ MX = 80. Vậy X là Brom.
Câu 4: Để tinh chế brom bị lẫn tạp chất clo, người ta dẫn hỗn hợp qua
A. dung dịch NaBr.
B. dung dịch NaI.
C. dung dịch NaCl.
D.dung dịch H2SO4.
Lời giải:
Đáp án A.
Cl2 + 2NaBr → 2NaCl + Br2
Câu 5: Trong các đơn chất halogen, chất ở trạng thái lỏng ở điều kiện thường là
A. Cl2. B. F2.
C. Br2. D. I2.
Lời giải:
Đáp án C
Điều kiện thường, brom tồn tại ở trạng thái lỏng.
Câu 6: Dãy các đơn chất halogen nào sau đây được xếp theo thứ tự tính oxi hóa tăng dần?
A. F2, Cl2, Br2, I2
B. Cl2, Br2, I2, F2
C. Cl2, F2, Br2, I2
D. I2, Br2, Cl2, F2
Lời giải:
Đáp án: D
Câu 7: Cho các phản ứng:
(1) SiO2 + dung dịch HF →
(2) F2 + H2O to→
(3) AgBr ánh sáng→
(4) Br2 + NaI (dư) →
Trong các phản ứng trên, những phản ứng có tạo ra đơn chất là
A. (1), (2), (3)
B. (1), (3), (4)
C. (2), (3), (4)
D. (1), (2), (4)
Lời giải:
Đáp án: C
(1) SiO2 + dung dịch HF → SiF4 + 2H2O
(2) F2 + H2O to→ 4HF + O2 ↑
(3) AgBr ánh sáng→ 2Ag + Br2
(4) Br2 + NaI (dư) → NaBr + I2
Câu 8: Phản ứng giữa hiđro và chất nào sau đây là phản ứng thuận nghịch?
A. Flo. B. Clo.
C. Iot. D. Brom.
Lời giải:
Đáp án C
Câu 9: Cho 1,12 lít (đktc) halogen X2 tác dụng vừa đủ với đồng kim loại thu được 11,2 gam CuX2. Nguyên tố halogen là
A. Flo. B. Clo.
C. Brom. D. Iot.
Lời giải:
Đáp án C
⇒ 64 + 2.MX = 224 ⇒ MX = 80. Vậy X là Brom.
Câu 10: Khi nung nóng, iot rắn chuyển ngay thành hơi, không qua trạng thái lỏng. Hiện tượng này được gọi là
A. sự thăng hoa. B. sự bay hơi.
C. sự phân hủy. D. sự ngưng tụ.
Lời giải:
Đáp án A
Quá trình chất chuyển từ trạng thái rắn sang trạng thái hơi, không qua trạng thái lỏng gọi là quá trình thăng hoa.
Câu 11: Số electron lớp ngoài cùng của các nguyên tử F, Br là
A. 7 B. 6
C. 5 D. 4
Lời giải:
Đáp án A
F, Br thuộc nhóm halogen (nhóm VIIA), do đó số electron lớp ngoài cùng là 7.
Câu 12: Thuốc thử để nhận ra iot là
A. hồ tinh bột. B. nước brom.
C. phenolphthalein. D. quì tím.
Lời giải:
Đáp án A
Iot làm xanh hồ tinh bột.
Câu 13: Dẫn từ từ clo vào dung dịch NaI có chứa sẵn một ít hồ tinh bột. Hiện tượng xảy ra là
A. Không hiện tượng.
C. Dung dịch chuyển sang màu xanh.
B. Dung dịch hóa đỏ.
D. Dung dịch xuất hiện kết tủa.
Lời giải:
Đáp án C
Cl2 + 2NaI → I2 + 2NaCl
I2 sinh ra làm xanh hồ tinh bột.
Câu 14: Để tinh chế brom bị lẫn tạp chất clo, người ta dẫn hỗn hợp qua
A. dung dịch NaBr.
B. dung dịch NaI.
C. dung dịch NaCl.
D.dung dịch H2SO4.
Lời giải:
Đáp án A.
Cl2 + 2NaBr → 2NaCl + Br2
Câu 15: Nguyên nhân gây ra bệnh fluorosis (bệnh chết răng) là
A. nguồn thực phẩm bị nhiễm độc thuốc trừ sâu.
B. nguồn nước bị ô nhiễm flo.
C. nước thải có hợp chất chứa oxi của clo vượt quá mức cho phép.
D. người dân không sử dụng kem đánh răng.
Lời giải:
Đáp án B
Câu 16: Cho biết các phản ứng xảy ra sau:
(1) 2FeBr2 + Br2 → 2FeBr3
(2) 2NaBr + Cl2 → 2NaCl + Br2. Phát biểu đúng là
A. Tính oxi hóa của Br2 mạnh hơn Cl2.
B. Tính khử của Cl− mạnh hơn của Br−.
C. Tính khử của Br− mạnh hơn Fe2+.
D. Tính oxi hóa của Cl2 mạnh hơn Fe3+.
Lời giải:
Đáp án D
Từ phương trình (2): 2NaBr + Cl2 → 2NaCl + Br2 ta suy ra tính oxi hóa của Cl2 mạnh hơn Br2.
Mặt khác từ (1): 2FeBr2 + Br2 → 2FeBr3 nên tính oxi hóa của Br2 mạnh hơn Fe3+.
Câu 17: Nguyên tố nào sau đây không thuộc nhóm halogen?
A. F. B. Br.
C. P. D. I.
Lời giải:
Đáp án C
P thuộc nhóm VA, không phải nhóm halogen.
Câu 18: Liên kết trong phân tử halogen (X2) có đặc điểm là
A. bền. B. rất bền.
C. không bền lắm. D. rất yếu.
Lời giải:
Đáp án C
Liên kết trong phân tử halogen không bền lắm, chúng dễ tách thành hai nguyên tử.
Câu 19: Tính chất hóa học cơ bản của các đơn chất halogen là
A. tính oxi hóa.
B. tính khử.
C. tính kim loại.
D. vừa có tính oxi hóa, vừa có tính khử.
Lời giải:
Đáp án C
Khi tham gia phản ứng hóa học, các nguyên tử halogen có xu hướng nhận thêm 1 electron để hình thành liên kết. Do đó tính chất hóa học cơ bản của các đơn chất halogen là tính oxi hóa.
Câu 20: Trong các chất sau, chất nào có tính khử mạnh nhất?
A. Flo. B. Clo.
C. Brom. D. Iot.
Lời giải:
Đáp án D
Iot có bán kính nguyên tử lớn hơn F, Cl, Br nhưng có độ âm điện nhỏ nhất so với các nguyên tố trên, do đó Iot có tính khử mạnh nhất.
Câu 21: Trong các chất sau, chất nào có tính oxi hóa mạnh nhất?
A. Flo. B. Clo.
C. Brom. D. Iot.
Lời giải:
Đáp án A
Nguyên tố Flo có độ âm điện lớn nhất nên phi kim có tính oxi hóa mạnh nhất.
Câu 22: Phản ứng nào sau đây là sai?
A. 2F2 + 2H2O → 4HF + O2.
B. Cl2 + H2O ⇆ HCl + HClO.
C. Br2 + H2O ⇆ HBr + HBrO.
D. F2 + H2O ⇆ HF + HFO.
Lời giải:
Đáp án D
Flo có tính oxi hóa rất mạnh, hơi nước có thể bốc cháy ngay khi gặp F2.
Câu 23: Phản ứng hóa học nào sau đây không xảy ra?
A. 2KOH + Cl2 → KClO + KCl + H2O.
B. 2KCl + Br2 → Cl2 + 2KBr.
C. Cl2 + 2KI → 2KCl + I2.
D. Cu + Cl2 → CuCl2.
Lời giải:
Đáp án B
Tính oxi hóa của Br2 yếu hơn Cl2.
Câu 24: Trong công nghiệp iot chủ yếu được sản xuất từ nguồn nguyên liệu nào?
A. Nước biển. B. Muối ăn.
C. Rong biển. D. Tro.
Lời giải:
Đáp án C
Trong công nghiệp, Iot chủ yếu sản xuất từ rong biển.
Câu 25: Halogen nào được ứng dụng để tạo hợp chất chống dính trong xoong, chảo, nồi cơm điện… ?
A. Flo. B. Iot.
C. Brom. D. Clo.
Lời giải:
Đáp án A
Hợp chất của Flo được ứng dụng để chế tạo hợp chất chống dính.
Câu 26: Trong các đơn chất halogen, chất ở trạng thái lỏng ở điều kiện thường là
A. Cl2. B. F2.
C. Br2. D. I2.
Lời giải:
Đáp án C
Điều kiện thường, brom tồn tại ở trạng thái lỏng.
Câu 27: Trong y tế, đơn chất halogen nào được hòa tan trong etanol để dùng làm chất sát trùng vết thương?
A. Cl2. B. F2.
C. I2. D. Br2.
Lời giải:
Đáp án C
I2 được dùng để sát trùng vết thương.
Câu 28: Liên kết trong phân tử halogen (X2) là liên kết
A. ion.
B. cộng hóa trị phân cực.
C. cho nhận.
D. cộng hóa trị không phân cực.
Lời giải:
Đáp án D
Liên kết trong phân tử đơn chất là liên kết cộng hóa trị không phân cực.
Câu 29: Cho 5,965 gam hỗn hợp A gồm: NaX, NaY (X,Y là hai halogen liên tiếp, nguyên tử khối của X < Y) vào dung dịch AgNO3 dư. Kết thúc phản ứng thu được 1,435 gam kết tủa. Hai nguyên tố X, Y lần lượt là
A. F và Cl. B. Cl và Br.
C. Br và I. D. Cl và F.
Lời giải:
Đáp án A
Trường hợp 1: X là Flo và Y là Clo. Ta có PTHH:
mNaCl = 0,01.58,5 = 0,585 < 5,965 (thỏa mãn)
Trường hợp 2: X khác F gọi X, Y là E (điều kiện: 35,5 < ME < 127). Ta có PTHH:
NaE + AgNO3 → AgE + NaNO3
Ta có số mol NaE = số mol AgE
Giải PT ⇒ ME < 0 (loại).
Câu 30: Cho 1,15 gam Na tác dụng vừa đủ với halogen (X2) thu được 5,15 gam muối. Nguyên tố halogen X là
A. Flo. B. Clo.
C. Brom. D. Iot.
Lời giải:
Đáp án A
MNaX = 5,15 : 0,05 = 103 ⇒ MX = 80. Vậy X là Br.
Xem thêm các dạng câu hỏi và bài tập hay khác:
30 bài tập về Hydrogen halide. Muối halide (2024) có đáp án chi tiết nhất
30 bài tập về Phản ứng oxi hóa - khử (2024) có đáp án chi tiết nhất
30 bài tập về Liên kết ion (2024) có đáp án chi tiết nhất
30 bài tập về phương pháp bảo toàn electron (2024) có đáp án chi tiết nhất
30 bài tập về biến thiên Enthalpy trong các phản ứng hóa học (2024) có đáp án chi tiết nhất