Bài tập về Hydrogen halide. Muối halide
Lý thuyết
Hydrogen halide
1. Cấu tạo phân tử
Phân tử hydrogen halide (HX) gồm một liên kết cộng hóa trị. Các phân tử HX là phân tử phân cực.
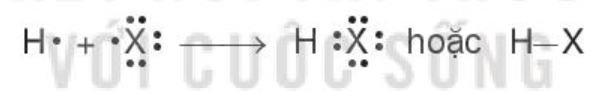 Mô hình liên kết:
Mô hình liên kết:
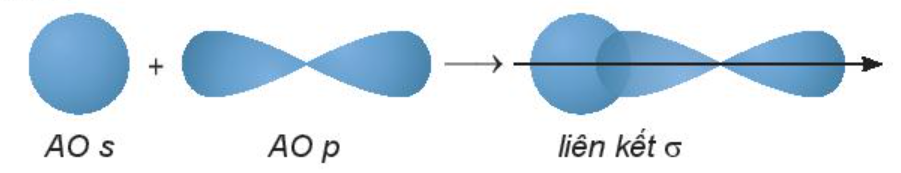
2. Tính chất vật lí
Ở điều kiện thường, hydrogen halide tồn tại ở thể khí, tan tốt trong nước, tạo thành dung dịch hydrohalic aicd tương ứng.
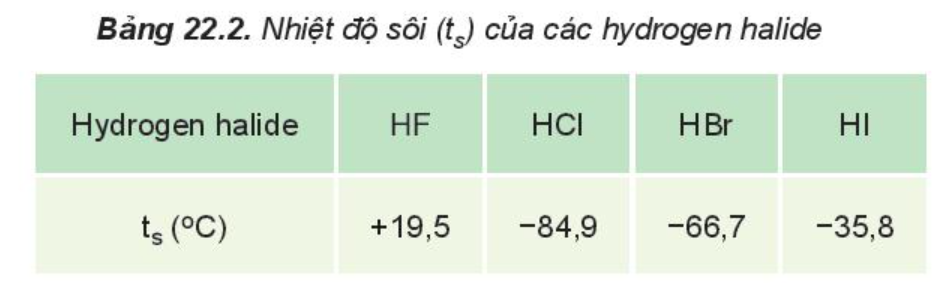
Nhận xét:
HF lỏng có nhiệt độ sôi cao bất thường là do phân tử HF phân cực mạnh, có khả năng tạo liên kết hydrogen:
Từ HCl đến HI, nhiệt độ sôi tăng do:
- Lực tương tác van der Waals giữa các phân tử tăng.
- Khối lượng phân tử tăng.
Hydrohalic acid
1. Tính chất hóa học
a) Tính acid
Trong dãy hydrohalic acid, tính acid tăng từ hydrofluoric acid (yếu) đến hydroiodic acid (rất mạnh).
b) Tính khử
Ngoài tính acid, hydrohalic acid còn có tính khử.
Ví dụ:
2. Ứng dụng
a) Hydrogen fluoride
Hydrogen fluoride được sử dụng trong quá trình sản xuất teflon (dùng làm chất chống dính ở nồi, chảo) theo sơ đồ:
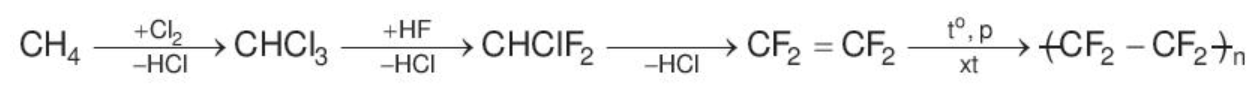
Hydrofluoric acid còn có khả năng đặc biệt là ăn mòn thủy tinh vô cơ (có thành phần gần đúng là Na2O.CaO.6SiO2) do xảy ra phản ứng:
SiO2 + 4HF SiF4 + 2H2O
Trong công nghiệp, hỗn hợp có thành phần KF.3HF được dùng để điện phân nóng chảy sản xuất fluorine.
b) Hydrogen chloride
Trong sản xuất tôn, thép, hydrochloric acid được sử dụng phổ biến để loại bỏ gỉ sét trên sắt thép trước khi chuyển sang các công đoạn sản xuất tiếp theo.
Trong công nghiệp, hydrochloric acid được dùng để sản xuất các hợp chất vô cơ và hữu cơ: aluminium chloride dùng làm chất phụ gia chống nhòe cho giấy, PAC dùng để xử lí nước, nickel chloride dùng trong mạ điện, …
Trong sản xuất nước uống đóng chai, hydrochloric acid tinh khiết được sử dụng để tái sinh các nhựa trao đổi ion nhằm thay thế các ion Na+ và Ca2+ (đã bị hấp phụ trên nhựa trong quá trình khử khoáng nước nguyên liệu) bằng ion H+.
Muối halide
1. Tính tan
Hầu hết các muối halide đều dễ tan trong nước, trừ một số muối không tan silver chloride, silver bromide, silver iodide và một số muối ít tan như lead chloride, lead bromide.
2. Tính chất hóa học
a) Phản ứng trao đổi
NaF + AgNO3 Không xảy ra
NaCl + AgNO3 NaNO3 + AgCl (kết tủa trắng)
NaBr + AgNO3 NaNO3 + AgBr (kết tủa vàng nhạt)
NaI + AgNO3 NaNO3 + AgI (kết tủa màu vàng)
Như vậy, có thể dùng dung dịch silver nitrate (AgNO3) để phân biệt các ion halide.
b) Tính khử của ion halide
Sodium bromide khử được sulfuric acid đặc thành sulfur dioxide, còn sodium iodide có thể khử được sulfuric acid đặc thành hydrogen sulfide.
2NaBr + 3H2SO4 2NaHSO4 + Br2 + SO2 + 2H2O
8NaI + 9H2SO4 8NaHSO4 + 4I2 + H2S + 4H2O
Trong điều kiện như trên, NaCl chỉ xảy ra phản ứng trao đổi, tạo thành hydrogen chloride.
Nhận xét: Tính khử của các ion halide tăng dần theo thứ tự Cl- < Br- < I-.
3. Muối ăn
a) Vai trò của muối ăn
Trong cơ thể sống, muối ăn có vai trò quan trọng trong việc cân bằng điện giải, truyền dẫn xung điện thần kinh, trao đổi chất, …
Trong đời sống, muối ăn được dùng sản xuất nước muối sinh lí, nước nhỏ mắt, dịch tiêm truyền tĩnh mạch, …
Trong công nghiệp, muối ăn là nguyên liệu để sản xuất xút, chlorine, nước Javel, …
b) Tinh chế muối ăn
Muối ăn thường được sản xuất từ nước biển bằng phương pháp kết tinh nhờ quá trình làm bay hơi nước biển dưới sức nóng của Mặt Trời.
Chú ý: Để đạt được độ tinh khiết làm thức ăn cho con người, muối ăn thô cần được kết tinh lại. Trong y học, muối ăn được sử dụng có độ tinh khiết rất cao, do đó cần kết tinh lại nhiều lần.
Bài tập tự luyện (có hướng dẫn)
Câu 1. Acid nào sau đây có khả năng ăn mòn thủy tinh vô cơ (có thành phần gần đúng là Na2O.CaO.6SiO2)?
A. HI.
B. HBr.
C. HCl.
D. HF.
Đáp án: D
Giải thích:
Hydrofluoric acid còn có khả năng đặc biệt là ăn mòn thủy tinh vô cơ (có thành phần gần đúng là Na2O.CaO.6SiO2) do xảy ra phản ứng:
SiO2 + 4HF SiF4 + 2H2O
Câu 2. Nhận xét nào sau đây là đúng?
A. Hầu hết các muối halide đều không trong nước.
B. Hầu hết các muối halide đều dễ tan trong nước.
C. Tất cả các muối halide đều không trong nước.
D. Tất cả các muối halide đều dễ tan trong nước.
Đáp án: B
Giải thích:
Hầu hết các muối halide đều dễ tan trong nước, trừ một số muối không tan silver chloride, silver bromide, silver iodide và một số muối ít tan như lead chloride, lead bromide.
Câu 3. Nhỏ từ từ dung dịch NaCl vào dung dịch AgNO3. Nêu hiện tượng quan sát được.
A. Thấy có khí thoát ra.
B. Thấy xuất hiện kết tủa trắng.
C. Thấy xuất hiện kết tủa vàng.
D. Không có hiện tượng gì.
Đáp án: B
Giải thích:
Nhỏ từ từ dung dịch NaCl vào dung dịch AgNO3.
Hiện tượng: Thấy xuất hiện kết tủa trắng.
Phương trình hóa học: NaCl + AgNO3 NaNO3 + AgCl¯.
Câu 4. Có thể dùng dung dịch nào sau đây để phân biệt các ion halide?
A. NaOH.
B. H2SO4.
C. AgNO3.
D. Ba(OH)2.
Đáp án: C
Giải thích:
Có thể dùng dung dịch silver nitrate (AgNO3) để phân biệt các ion halide.
Ví dụ:
NaF + AgNO3 Không xảy ra
NaCl + AgNO3 NaNO3 + AgCl¯ (kết tủa trắng)
NaBr + AgNO3 NaNO3 + AgBr¯ (kết tủa vàng nhạt)
NaI + AgNO3NaNO3 + AgI¯ (kết tủa màu vàng)
Câu 5. Sodium bromide khử được sulfuric acid đặc thành
A. hydrogen sulfide.
B. sulfur.
C. hydrogen.
D. sulfur dioxide.
Đáp án: D
Giải thích:
Sodium bromide khử được sulfuric acid đặc thành sulfur dioxide:
2NaBr + 2H2SO4 Na2SO4 + Br2 + SO2 + 2H2O
Câu 6. Phân tử hydrogen halide (HX) gồm
A. một liên kết ion.
B. một liên kết cộng hóa trị.
C. một liên kết cho nhận.
D. một liên kết hydrogen.
Đáp án: B
Giải thích:
Phân tử hydrogen halide (HX) gồm một liên kết cộng hóa trị. Các phân tử HX là phân tử phân cực.
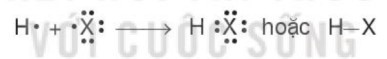
Câu 7. Ở điều kiện thường, hydrogen halide
A. tồn tại ở thể khí, tan ít trong nước.
B. tồn tại ở thể lỏng, tan ít trong nước.
C. tồn tại ở thể khí, tan tốt trong nước.
D. tồn tại ở thể lỏng, tan tốt trong nước.
Đáp án: C
Giải thích:
Ở điều kiện thường, hydrogen halide tồn tại ở thể khí, tan tốt trong nước, tạo thành dung dịch hydrohalic aicd tương ứng.
Câu 8. Từ HCl đến HI, nhiệt độ sôi
A. tăng dần.
B. giảm dần.
C. tăng sau đó giảm.
D. giảm sau đó tăng.
Đáp án: A
Giải thích:
Từ HCl đến HI, nhiệt độ sôi tăng do:
- Lực tương tác van der Waals giữa các phân tử tăng.
- Khối lượng phân tử tăng.
Câu 9. Cho phương trình hóa học của phản ứng:
![]()
Trong phản ứng trên, HCl đóng vai trò là
A. chất oxi hóa.
B. chất khử.
C. vừa là chất oxi hóa, vừa là chất khử.
D. không là chất oxi hóa, không là chất khử.
Đáp án: B
Giải thích:
Phương trình hóa học: ![]() .
.
HCl là chất khử; KMnO4 là chất oxi hóa.
Chú ý: Ngoài tính acid, hydrohalic acid còn có tính khử.
Câu 10. Chất nào sau đây không tác dụng với dung dịch hydrochloric acid?
A. Cu.
B. MgO.
C. Cu(OH)2.
D. AgNO3.
Đáp án: A
Giải thích:
Kim loại Cu không tác dụng với dung dịch hydrochloric acid.
MgO, Cu(OH)2, AgNO3 tác dụng với dung dịch hydrochloric acid.
Phương trình hóa học:
MgO + 2HCl MgCl2 + H2O
Cu(OH)2 + 2HCl CuCl2 + 2H2O
AgNO3 + HCl AgCl↓ + HNO3
Câu 11. Tính khử của các ion halide tăng dần theo thứ tự
A. Cl- < Br- < I-.
B. Br- < I- < Cl-.
C. I- < Cl- < Br-.
D. Cl- < I- < Br-.
Đáp án: A
Giải thích:
Tính khử của các ion halide tăng dần theo thứ tự Cl- < Br- < I-.
Câu 12. Muối ăn thường được sản xuất từ
A. nước vôi trong.
B. nước biển.
C. nước giếng.
D. nước sông suối.
Đáp án: B
Giải thích:
Muối ăn thường được sản xuất từ nước biển bằng phương pháp kết tinh nhờ quá trình làm bay hơi nước biển dưới sức nóng của Mặt Trời.
Câu 13. Phát biểu nào sau đây không đúng?
A. Trong công nghiệp, hỗn hợp có thành phần KF.3HF được dùng để điện phân nóng chảy sản xuất fluorine.
B. Sodium iodide có thể khử được sulfuric acid đặc thành hydrogen.
C. Trong đời sống, muối ăn được dùng sản xuất nước muối sinh lí, nước nhỏ mắt, dịch tiêm truyền tĩnh mạch, …
D. Các phân tử hydrogen halide (HX) là phân tử phân cực.
Đáp án: B
Giải thích:
Sodium iodide có thể khử được sulfuric acid đặc thành hydrogen sulfide:
8NaI + 5H2SO4 ® 4Na2SO4 + 4I2 + H2S + 4H2O
Câu 14. Để pha 500g nước muối sinh lí NaCl 0,9% dùng làm nước xúc miệng thì cần bao nhiêu gam muối ăn?
A. 4,5 gam.
B. 5,5 gam.
C. 7,5 gam.
D. 9,0 gam.
Đáp án: A
Giải thích:
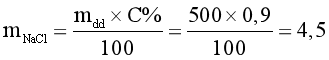 (gam).
(gam).
Câu 15. Cho X, Y là hai nguyên tố halogen có trong tự nhiên, ở hai chu kì liên tiếp (ZX < ZY). Hòa tan hoàn toàn 11 gam hỗn hợp NaX và NaY vào nước thu được dung dịch A. Cho từ từ A vào cốc đựng dung dịch AgNO3 dư, thu được 23,75 gam kết tủa. Biết cả NaX và NaY đều tạo kết tủa với AgNO3. Kí hiệu của hai nguyên tố X và Y lần lượt là
A. F và Cl.
B. Cl và Br.
C. Br và I.
D. Cl và I.
Đáp án: B
Giải thích:
Gọi công thức chung của hai muối NaX và NaY là ![]() .
.
Phương trình hóa học: ![]() + AgNO3 ®
+ AgNO3 ® ![]() + NaNO3.
+ NaNO3.
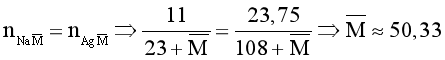 .
.
Nguyên tố X là Cl (M = 35,5) và nguyên tố Y là Br (M = 80).
Xem thêm các dạng câu hỏi và bài tập liên quan khác:
30 Bài tập về Tính chất vật lí và hóa học các đơn chất nhóm VIIA (2024) có đáp án chi tiết nhất
30 Bài tập về Nhóm Halogen (2024) có đáp án chi tiết nhất
30 bài tập về Brom (2024) có đáp án chi tiết nhất
30 Bài tập về Hydrogen halide và hydrohalic acid (2024) có đáp án chi tiết nhất
30 bài tập về biến thiên Enthalpy trong các phản ứng hóa học (2024) có đáp án chi tiết nhất




