Bài tập về nguyên tử
I. Lý thuyết
1. Định nghĩa
- Nguyên tử là hạt vô cùng nhỏ, trung hoà về điện, cấu tạo nên các chất.
- Đường kính nguyên tử khoảng 10-8 cm
Ví dụ về sự nhỏ bé của nguyên tử: 4 triệu nguyên tử sắt xếp liền nhau mới dài cỡ 1 mm!
2. Cấu tạo
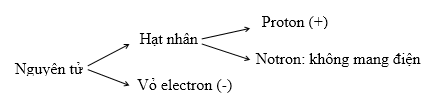
|
|
Hạt electron |
Hạt proton |
Hạt nơtron |
|
Kí hiệu |
e |
p |
n |
|
Điện tích |
- 1 |
+ 1 |
Không mang điện |
Chú ý: Hiđro là nguyên tử đặc biệt chỉ có duy nhất một hạt proton.
3. Lớp electron
- Trong nguyên tử, các e chuyển động rất nhanh và sắp xếp thành từng lớp từ trong ra ngoài, có một số electron nhất định.
+ Lớp 1: có tối đa 2e
+ Lớp 2, 3, 4… tối đa 8e
- Khối lượng nguyên tử = số P + số N + số e = số P + số N (vì e có khối lượng rất nhỏ nên bỏ qua).
4. Phương pháp giải
+ Bước 1: Tính số mol các chất đề bài đã cho số liệu và viết phương trình phản ứng hóa học xảy ra.
+ Bước 2: Tính toán luôn theo phương trình phản ứng hóa học hoặc đặt ẩn nếu đề bài là hỗn hợp.
+ Bước 3: Lập phương trình toán học và giải phương trình Số mol các chất cần tìm.
+ Bước 4: Tính toán theo yêu cầu đề bài.
Lưu ý: Trong một hỗn hợp mà có nhiều phản ứng xảy ra thì phản ứng trung hoà được ưu tiên xảy ra trước.
II. Ví dụ minh hoạ
Ví dụ 1: Một nguyên tố hoá học có thể có nhiều nguyên tử có khối lượng khác nhau vì lí do nào dưới đây?
A. Hạt nhân có cùng số nơtron nhưng khác nhau về số proton.
B. Hạt nhân có cùng số proton nhưng khác nhau về số nơtron.
C. Hạt nhân có cùng số nơtron nhưng khác nhau về số electron.
D. Hạt nhân có cùng số proton và số electron.
Lời giải:
Chọn đáp án: B.
Giải thích: Sự khác nhau về số nơtron tạo ra các đồng vị của cùng một nguyên tố.
Ví dụ 2: Phân lớp 3d có số electron tối đa là
A. 6. B. 18.
C. 10. D. 14.
Lời giải:
Chọn đáp án: C.
Giải thích: Số electron tối đa trên phân lớp s = 2, p =6, d = 10, f = 14.
Ví dụ 3: Cho cấu hình electron nguyên tử các nguyên tố sau:
a) 1s22s1
b) 1s22s22p5
c) 1s22s22p63s23p1
d) 1s22s22p63s2
e) 1s22s22p63s23p4
Cấu hình của các nguyên tố phi kim là
A. a, b.
B. b, c.
C. c, d.
D. b, e.
Lời giải:
Chọn đáp án: D.
Giải thích:
Nguyên tố có 5, 6, 7 electron lớp ngoài cùng là phi kim.
a) 1e lớp ngoài cùng b) 7e lớp ngoài cùng c) 3e lớp ngoài cùng
d) 2e lớp ngoài cùng e) 6e lớp ngoài cùng
III. Bài tập vận dụng
Bài 1: Nguyên tử gồm:
A. Các hạt electron và nơtron
B. Hạt nhân mang điện dương và lớp vỏ mang điện âm
C. Các hạt proton và nơtron
D. Các hạt proton và electron
Lời giải:
Chọn đáp án: B.
Giải thích: Nguyên tử được cấu tạo bởi hai phần : Hạt nhân và lớp vỏ.
Bài 2: Trong nguyên tử, hạt không mang điện là:
A. Nơtron và Proton
B. Proton
C. Electron
D. Nơtron
Lời giải:
Chọn đáp án: D.
Bài 3: Khối lượng nguyên tử tập trung hầu hết ở hạt nhân và được tính bằng
A. Tổng số hạt proton và tổng số hạt nơtron
B. Tổng khối lượng của proton, nơtron và electron có trong nguyên tử
C. Tổng khối lượng của các hạt nơtron và electron
D. Tổng khối lượng của proton và electron
Lời giải:
Chọn đáp án: A
Giải thích: Do khối lượng của các eletron là không đáng kể so với khối lượng nguyên tử.
Bài 4: Mệnh đề nào sau đây sai:
A. Số proton bằng trị số điện tích hạt nhân
B. Số hiệu nguyên tử bằng trị số của điện tích hạt nhân nguyên tử
C. Số proton bằng số electron
D. Số proton bằng số nơtron
Lời giải:
Chọn đáp án: D
Bài 5: Chọn đáp án đúng: Các hạt cấu tạo nên hạt nhân của hầu hết nguyên tử là:
A. Proton và nơtron
B. Electron và proton.
C. Electron , proton và nơtron.
D. Nơtron và electron
Lời giải:
Chọn đáp án: A.
Giải thích: Hạt nhân của các nguyên tử đều được cấu tạo nên từ hai loại hạt: Proton và nơtron (trừ nguyên tử Hidro).
Bài 6: Ion có 18 electron và 16 proton mang điện tích là
A. 16+.
B. 2−.
C. 18−.
D. 2+.
Lời giải:
Chọn đáp án: B.
Bài 7: Tổng số hạt proton, nơtron và electron trong 1 nguyên tử nguyên tố X là 155, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 33 hạt. X là nguyên tố nào dưới đây?
A. Cu
B. Ag
C. Fe
D. Al
Lời giải:
Chọn đáp án: B
Giải thích:
Tổng số hạt proton, nơtron và electron trong 1 nguyên tử nguyên tố X là 155:
P + e + n = 155 hay 2p + n = 155 (do p = e) (1)
Số hạt mang điện (p và e) nhiều hơn số hạt không mang điện (n) là 33 hạt
(p+e) – n = 33 hay 2p – n = 33 (2)
Giải (1), (2) ta có p = e = 47
Bài 8: Kí hiệu nguyên tử biểu thị đầy đủ đặc trưng cho một nguyên tử của một nguyên tố hoá học vì nó cho biết
A. số khối A
B. số hiệu nguyên tử Z
C. nguyên tử khối của nguyên tử
D. số khối A và số hiệu nguyên tử Z
Lời giải:
Chọn đáp án: D.
Bài 9: Tổng số hạt p, n, e trong nguyên tử 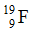
A. 19. B. 28.
C. 30. D. 32.
Lời giải:
Chọn đáp án: B.
Giải thích:
Số hạt p = e = 9, số n = A-P = 19 – 9 = 10.
Tổng số hạt p + n + e = 28.
Bài 10: Phát biểu nào dưới đây không đúng?
A. Số khối bằng tổng số hạt proton và electron.
B. Số khối là số nguyên.
C. Số khối bằng tổng số hạt proton và nơtron.
D. Số khối kí hiệu là A.
Lời giải:
Chọn đáp án: A.
Giải thích: Số khối bằng tổng số hạt proton và nơtron.
Xem thêm các dạng bài tập Hoá học khác:
100 bài tập về mẫu nguyên tử Bo. quang phổ nguyên tử Hidro (có đáp án năm 2024)
30 Bài tập về Mô hình nguyên tử và orbital nguyên tử (2024) có đáp án chi tiết nhất
50 Bài tập thành phần của nguyên tử (2024) có đáp án chi tiết nhất
50 Bài tập về cấu trúc lớp vỏ electron nguyên tử (2024) có đáp án chi tiết nhất




