Giải SBT Khoa học tự nhiên 8 Bài 6: Nồng độ dung dịch
A. 32 gam/100 gam H2O. B. 36 gam/100 gam H2O.
C. 80 gam/100 gam H2O. D. 40 gam/100 gam H2O.
Lời giải:
Ở 25 oC, 250 gam nước có thể hòa tan tối đa 80 gam KNO3.
Ở 25 oC, 100 gam nước có thể hòa tan tối đa x gam KNO3.
Vậy x = = 32 gam.
Bài 6.2 trang 17 Sách bài tập KHTN 8: Khối lượng CuSO4 có trong 100 ml dung dịch CuSO4 0,5M là
A. 80 gam. B. 160 gam. C. 16 gam. D. 8 gam.
Lời giải:
Đáp án đúng là: D
Số mol CuSO4: n = 0,1 × 0,5 = 0,05 mol.
Vậy khối lượng CuSO4 có trong dung dịch: m = 0,05 × 160 = 8 gam.
A. 0,05 M. B. 0,10 M. C. 0,20 M. D. 0,03 M.
Lời giải:
Đáp án đúng là: C
Số mol NaCl: n = 0,2 × 0,5 = 0,1 mol.
Thể tích dung dịch sau pha: Vdd = 0,2 + 0,3 = 0,5 lít
Nồng độ mol của dung dịch thu được là:
CM = = 0,20 M.
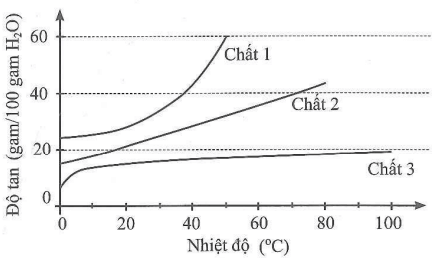
Nhận xét nào sau đây đúng?
A. Đối với chất 1, khi nhiệt độ tăng thì độ tan giảm.
B. Độ tan của chất 2 ở 70 oC gấp đôi ở 0 oC.
C. Ở 20 oC, độ tan của chất 1 gấp đôi chất 3.
D. Độ tan của chất 3 ở 60 oC lớn hơn độ tan của chất 1 ở 20 oC.
Lời giải:
Đáp án đúng là: C
Nhìn vào đồ thị ta thấy: Ở 20 oC, độ tan của chất 1 gấp đôi chất 3.
hòa tan; bão hòa; nước; hỗn hợp; nhiệt độ; chất không tan;
dung môi; thể rắn; chất tan; bay hơi; thể tích; dung dịch.
Dung dịch là …(a)… lỏng đồng nhất của các chất đã tan trong nhau. Chất tan là chất …(b)… trong chất lỏng. Chất lỏng hòa tan chất tan gọi là …(c)… Chất tan và dung môi tạo thành …(d)… Chất rắn không tan trong chất lỏng được gọi là …(e)…
Độ tan của một chất rắn trong nước được đo bằng khối lượng chất rắn đó có trong 100 gam …(g)… Độ tan của một chất phụ thuộc vào …(h)…
Lời giải:
(a): hỗn hợp (b): hoà tan (c): dung môi (d): dung dịch
(e): chất không tan (g): nước (h) : nhiệt độ.
Cách pha chế 50 ml dung dịch NaOH 1M: cân …(1)… gam NaOH, cho vào cốc thủy tinh 100 ml. Đổ dần nước cất vào cốc và khuấy nhẹ đến vạch …(2)…ml thì dừng lại, thu được …(3)…ml dung dịch NaOH nồng độ …(4)…M.
Lời giải:
(1): 2 gam;
(2): 50 ml;
(3): 50 ml;
(4): 1 M.
|
Nhiệt độ của nước (oC) |
25 |
30 |
45 |
55 |
65 |
70 |
75 |
|
Khối lượng chất rắn hoà tan (gam) |
17 |
20 |
32 |
40 |
46 |
49 |
52 |
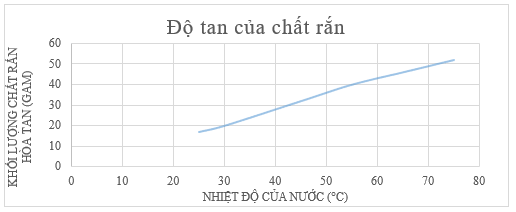
a) Vẽ đồ thị biểu diễn mối quan hệ giữa lượng chất rắn hòa tan và nhiệt độ của nước.
b) Dự đoán lượng chất rắn có thể bị hòa tan vào nước tại 35 oC và 80 oC.
c) Từ kết quả thu được ở trên, có thể rút ra kết luận gì về độ tan của chất?
Lời giải:
a) Vẽ đồ thị:
b) Dự đoán:
Lượng chất rắn hoà tan vào nước tại 35 oC là: 25 gam.
Lượng chất rắn hoà tan vào nước tại 80 oC là: 57 gam.
c) Từ kết quả ở trên, có thể kết luận độ tan của một chất trong nước phụ thuộc vào nhiệt độ.
Lời giải:
Nồng độ phần trăm dung dịch NaCl bão hoà ở 25 oC là:
C% =26,47%
Lời giải:
Số mol H2SO4: n = mol
CM = = 0,4 M.
Lời giải:
Khối lượng NaOH trong 120 gam dung dịch:
mNaOH = = 24 gam
Gọi khối lượng NaOH cần thêm là x gam
=> C% =
=> x = 8 gam.
HCl + NaOH → NaCl + H2O
Xác định nồng độ mol của dung dịch acid.
Lời giải:
Phương trình hoá học: HCl + NaOH → NaCl + H2O
Theo phương trình hoá học:
nHCl = nNaOH = 0,025 × 0,2 = 0,005 mol
Vậy CM (HCl) =
a) Cho biết tên của dụng cụ thí nghiệm.
b) Xác định thể tích của dung dịch hydrochloric acid.
c) Tính số mol của hydrochloric acid trong dụng cụ trên.
Lời giải:
a) Dụng cụ thí nghiệm: Ống đong.
b) Thể tích dung dịch hydrochloric acid: 44 ml.
c) Số mol hydrochloric acid: nHCl = 0,044 . 0,01 = 4,4 . 10-4 mol.
Lời giải:
- Số mol NaCl có trong 250 ml dung dịch NaCl 0,2 M:
nNaCl = 0,25 . 0,2 = 0,05 mol
- Thể tích dung dịch NaCl 1 M cần lấy: V = = 0,05 lít = 50 ml.
- Cách pha:
+ Lấy 50 ml dung dịch NaCl 1 M cho vào bình 500 ml.
+ Thêm nước cất và khuấy đều đến mức 250 ml thì dừng lại.
+ Thu được 250 ml dung dịch NaCl 0,2 M.
Xem thêm lời giải Sách bài tập Khoa học tự nhiên 8 sách Cánh diều hay, chi tiết khác:
Bài 4: Mol và tỉ khối của chất khí
Bài 5: Tính theo phương trình hóa học