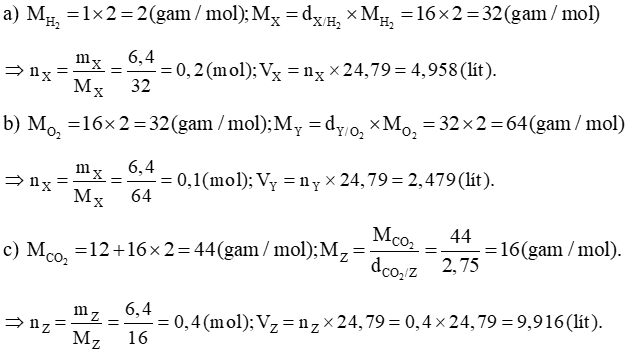Giải SBT Khoa học tự nhiên 8 Bài 4: Mol và tỉ khối của chất khí
Bài 4.1 trang 14 Sách bài tập KHTN 8: Số nguyên tử hydrogen trong 0,05 mol khí hydrogen là
A. 3,01 x 1022. B. 3,01 x 1023. C. 6,02 x 1022. D. 6,02 x 1024.
Lời giải:
Đáp án đúng là: A
Số nguyên tử hydrogen = 0,05 x 6,022 x 1023 = 3,01 x 1022 nguyên tử
Bài 4.2 trang 14 Sách bài tập KHTN 8: a mol khí chlorine 12,04 x 1023 phân tử Cl2. Giá trị của a là
A. 2. B. 6. C. 4. D. 0,5.
Lời giải:
Đáp án đúng là: A
Số mol khí chlorine là: a =12,04×10236,022×1023=1,999≈2
Bài 4.3 trang 14 Sách bài tập KHTN 8: Điền thông tin còn thiếu vào chỗ …… trong các câu sau:
a) Khối lượng của 2 mol Mg(OH)2 là ……
b) Số mol của 50 gam CaCO3 là ……
c) Số mol của 27 gam nước là ……
d) Khối lượng của 0,2 mol Na2O là ……
e) Số nguyên tử oxygen có trong 0,5 mol CO2 là ……
Lời giải:
a) Khối lượng của 2 mol Mg(OH)2 là 2 × 58 = 116 gam.
b) Số mol của 50 gam CaCO3 là 50100=0,5 mol.
c) Số mol của 27 gam nước là 2727=1 mol.
d) Khối lượng của 0,2 mol Na2O là 0,2.62 = 12,4 gam.
e) Số nguyên tử oxygen có trong 0,5 mol CO2 là 2 × 0,5 × 6,02 x 1023 = 6,02 x 1023 nguyên tử.
Bài 4.4 trang 14 Sách bài tập KHTN 8:
a) Hoàn thành thông tin trong bảng sau bằng cách điền vào chỗ …… cho phù hợp.
|
Ở cùng điều kiện nhiệt độ và áp suất |
Chất khí X |
Chất khí Y |
Chất khí Z |
|
Số mol (mol) |
1,5 |
3 |
……. |
|
Thể tích (lít) |
…… |
72 |
48 |
b) Hãy vẽ hình (lập phương, cầu …) so sánh thể tích các chất khí trên ở cùng điều kiện nhiệt độ và áp suất.
Lời giải:
a)
|
Ở cùng điều kiện nhiệt độ và áp suất |
Chất khí X |
Chất khí Y |
Chất khí Z |
|
Số mol (mol) |
1,5 |
3 |
2 |
|
Thể tích (lít) |
36 |
72 |
48 |
b)
Lời giải:
Khối lượng N phân tử oxygen: (16 × 2) × 1 = 32 gam.
Khối lượng N phân tử muối ăn: (23 + 35,5) × 1 = 58,5 gam.
Khối lượng N phân tử HCl: (1 + 35,5) × 1 = 36,5 gam.
Khối lượng N phân tử NaOH: (23 + 16 + 1) × 1 = 40 gam.
Khối lượng N phân tử CO2: (12 + 16 × 2) × 1 = 44 gam.
Khối lượng N phân tử H2SO4: (2 × 1 + 32 + 16 × 4) = 98 gam.
Bài 4.6 trang 14 Sách bài tập KHTN 8: Xác định tên các nguyên tố biết:
a) 0,02 mol nguyên tố X có khối lượng là 1,28 gam.
b) 0,5 mol nguyên tố Y có khối lượng là 16 gam.
c) 0,2 mol nguyên tố Z có khối lượng là 6,2 gam.
Lời giải:
a) MX=mXnX=1,280,02=64 (gam/mol)
Vậy X là nguyên tố đồng (copper (Cu)).
b) MY=mYnY=160,5=32 (gam/mol)
Vậy Y là nguyên tố lưu huỳnh (sulfur (S)).
c) MZ=mZnZ=6,20,2=31 (gam/mol)
Vậy Z là nguyên tố phosphorus (P).
Lời giải:
Khối lượng mol phân tử X là: MX + 2 × 16 = 44.
=> MX = 44 – 16 x 2 = 12 (gam/mol).
Vậy X là nguyên tố carbon (C).
a) Tỉ khối của khí X với H2 là 16.
b) Tỉ khối của khí Y với O2 là 2.
c) Tỉ khối của CO2 đối với khí Z là 2,75.
Lời giải:
a) Số mol chất và số phân tử mỗi chất khí có trong mỗi bình có bằng nhau không? Vì sao?
b) Xác định khí có trong mỗi bình, biết bình (1) có khối lượng khí nhỏ nhất, bình (3) có khối lượng khí lớn nhất, khối lượng khí trong bình (2) và (5) bằng nhau.
Lời giải:
a) Ở cùng điều kiện về nhiệt độ và áp suất thì các chất khí có thể tích bằng nhau sẽ có cùng số mol chất và số phân tử khí.
Do đó, số mol chất và số phân tử mỗi chất khí có trong mỗi bình là bằng nhau.
b) Bình (1) có khối lượng khí nhỏ nhất nên chứa khí hydrogen (do MH2=2 gam/mol), bình (3) có khối lượng khí lớn nhất nên chứa khí carbon dioxide (do MCO2 = 44 gam/mol), khối lượng khí trong bình (1) và (5) bằng nhau nên bình (2) và (5) chứa khí carbon monoxide hoặc nitrogen (do MN2=MCO=28 gam/mol), bình còn lại (bình 4) chứa khí oxygen.
Lời giải:
- Công thức hóa học của hai chất khí nhẹ hơn không khí (có phân tử khối nhỏ hơn 29): H2 (M = 2 gam/mol), N2 (M = 28 gam/mol).
Ngoài ra học sinh có thể kể: CO (M = 28 gam/mol), methane CH4 (M = 16 gam/mol), …
- Công thức hóa học của hai chất khí nặng hơn không khí (có phân tử khối lớn hơn 29): O2 (M = 32 gam/mol), CO2 (M = 44 gam/mol).
Ngoài ra học sinh có thể kể: Cl2 (M = 71 gam/mol), SO2 (M = 64 gam/mol), …
Lời giải:
Ở những nơi như rạp chiếu phim, rạp hát, … khi có đông người thì nồng độ khí CO2 lớn hơn bình thường. Vì vậy, các cửa sổ thường được thiết kế ở phía dưới gần sàn nhà để khí CO2 (nặng hơn không khí, nằm nhiều ở sát mặt đất) thoát ra ngoài dễ dàng hơn.
Xem thêm lời giải Sách bài tập Khoa học tự nhiên 8 sách Cánh diều hay, chi tiết khác:
Bài 2: Phản ứng hoá học và năng lượng của phản ứng hoá học
Bài 3: Định luật bảo toàn khối lượng phương trình hoá học