NaOH + Cl2 → NaCl + NaClO + H2O
1. Phản ứng hóa học của NaOH với Cl2
2NaOH + Cl2 → NaCl + NaClO + H2O
2. Điều kiện phản ứng
- Phản ứng xảy ra ngay điều kiện thường.
3. Cách thực hiện phản ứng
- Dẫn khí Cl2 vào ống nghiệm chứa dung dịch NaOH có chứa màu quỳ tím.
4. Hiện tượng nhận biết phản ứng
- Ban đầu mẩu quỳ có màu xanh, sau khi phản ứng xảy ra màu quỳ bị mất.
5. Mở rộng tính chất hóa học của Cl2
- Nguyên tử clo có độ âm điện lớn (3,16) chỉ sau F (3,98) và O (3,44). Vì vậy trong các hợp chất với các nguyên tố này clo có số oxi hóa dương (+1; +3; +5; +7), còn trong các trường hợp khác clo có số oxi hóa âm (-1).
- Khi tham gia phản ứng hóa học clo dễ dàng nhận thêm 1 electron:
Cl + 1e → Cl-
⇒ Tính chất hóa học cơ bản của clo là tính oxi hóa mạnh.
5.1. Tác dụng với kim loại
- Khí clo oxi hóa trực tiếp được hầu hết các kim loại tạo thành muối clorua. Phản ứng xảy ra ở nhiệt độ thường hoặc không cao lắm, phản ứng xảy ra nhanh, tỏa nhiều nhiệt.
- Ví dụ:
2Na + Cl2 t0→2NaCl
2Fe + 3Cl2 t0→2FeCl3
Cu + Cl2 t0→CuCl2
- Trong phản ứng với kim loại clo thể hiện tính oxi hóa.
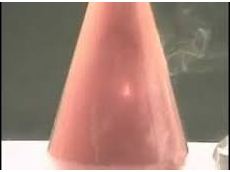
Hình 1: Dây sắt cháy trong khí clo
5.2. Tác dụng với hiđro
- Ở nhiệt độ thường và trong bóng tối, khí clo hầu như không phản ứng với khí hiđro.
- Khi chiếu sáng hỗn hợp bởi ánh sáng mặt trời hoặc ánh sáng của magie cháy, phản ứng xảy ra và có thể nổ. Hỗn hợp nổ mạnh nhất khi tỉ lệ số mol giữa hiđro và clo là 1 : 1.
- Phương trình hóa học:
H2 + Cl2 as→2HCl
- Trong phản ứng với H2, clo thể hiện tính oxi hóa.
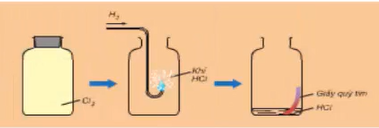
Hình 2: Clo tác dụng với hiđro
5.3. Tác dụng với nước
- Khi tan trong nước, một phần khí clo tác dụng với nước tạo ra hỗn hợp axit clohiđric và axit hipoclozơ.
- Phương trình hóa học:
0Cl2
Trong phản ứng trên clo vừa là chất oxi hóa vừa là chất khử.
- Phản ứng trên là phản ứng thuận nghịch do HClO là chất oxi hóa mạnh, có thể oxi hóa HCl thành Cl2 và H2O. Cũng do HClO có tính oxi hóa mạnh nên nước clo có tính tẩy màu.
- Chú ý: Thành phần của nước clo gồm: Cl2; HCl; HClO; H2O
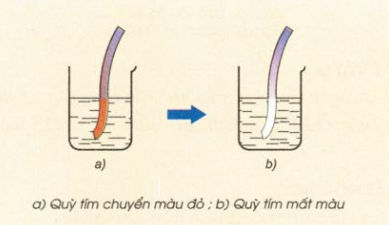
Hình 3: Nhúng giấy quỳ tím vào nước clo
5.4. Mở rộng
Ngoài ra, clo có thể tham gia một số phản ứng hóa học khác như:
- Tác dụng với dung dịch bazơ:
Cl2 + 2NaOH → NaCl + NaClO + H2O
3Cl2 + 6KOH KClO3 + 5KCl + 3H2O
- Tác dụng với muối của các halogen khác
Cl2 + 2NaBr → 2NaCl + Br2
Cl2 + 2FeCl2 → 2FeCl3
- Tác dụng với chất khử khác
3Cl2 + 2NH3 → N2 + 6HCl
Cl2 + SO2 + 2H2O → H2SO4 + 2HCl
6. Bạn có biết
- Phản ứng trên dung để điều chế nước gia – ven trong phòng thí nghiệm.
- NaClO có tính oxi hóa mạnh, có thể tẩy màu và tiêu diệt vi khuẩn.
7. Bài tập liên quan (có đáp án)
Câu 1: Cho V lít Cl2 (đktc) tác dụng với dung dịch NaOH loãng nguội, dư thu được m1 gam tổng khối lượng hai muối. Cho V lít Cl2 (đktc) tác dụng với NaOH đặc, nóng thu được m2 gam tổng khối lượng hai muối. Tỉ lệ m1: m2 bằng:
A. 1 : 1,5
B. 1 : 2
C. 1 : 1
D. 2 : 1
Lời giải:
Đáp án: C
Câu 2: Tiến hành các thí nghiệm sau:
(a) Sục khí Cl2 vào dung dịch NaOH ở nhiệt độ thường.
(b) Hấp thụ hết 2 mol CO2 vào dung dịch chứa 3 mol NaOH.
(c) Cho KMnO4 vào dung dịch HCl dư.
(d) Cho hỗn hợp Fe3O4 vào dung dịch HCl dư.
(e) Cho CuO vào dung dịch HNO3
(f) Cho KHS vào dung dịch NaOH vừa đủ.
Số thí nghiệm thu được hai muối là
A. 4
B. 3
C. 5
D. 6
Lời giải:
Đáp án: C
Các phản ứng hóa học xảy ra:
• (a) Cl2 + 2NaOH → NaCl + NaClO + H2O. (→ thỏa mãn).
• (b) 2CO2 + 3NaOH → 1Na2CO3 + 1NaHCO3 + 1H2O. (→ thỏa mãn).
• (c) 2KMnO4 + 16HCl → 2MnCl2 + 2KCl + 5Cl2 + 8H2O. (→ thỏa mãn).
• (d) Fe3O4 + 8HCl → 2FeCl3 + FeCl2 + 4H2O. (→ thỏa mãn)
• (e) CuO + 2HNO3 → Cu(NO3)2 + H2O (→ không thỏa mãn.!).
• (g) 2KHS + 2NaOH → Na2S + K2S + 2H2O.
⇒ có 5 thí nghiệm thỏa mãn thu được 2 muối
Câu 3: Chất nào sau đây có tính tẩy màu?
A. KCl. B. NaCl. C. NaClO. D. MgCl2.
Lời giải:
Đáp án: C
NaClO có tính oxi hóa mạnh, có thể tẩy màu và tiêu diệt vi khuẩn.
Câu 4: NaOH không thể phản ứng với khí nào sau?
A. SO2. B. CO2. C. Cl2. D. O2.
Lời giải:
Đáp án: D
NaOH không thể phản ứng với O2.
Câu 5: Hấp thụ hoàn toàn V lit khí Cl2 (dktc) vào 200 ml dung dịch NaOH 1,5M ở nhiệt độ thường, sau khi phản ứng xảy ra hoàn toàn thu được dung dịch X chứa các hợp chất tan có cùng nồng độ mol. Tính V.
A. 2,24 lít
B. 3,36 lít
C. 4,48 lít
D. 3,36 lít hoặc 4,48 lít
Lời giải:
Đáp án: D
2NaOH + Cl2 -> NaCl + NaClO + H2O
+) TH1 : sau phản ứng có NaCl ; NaClO ; NaOH có cùng nồng độ mol là x (M)
Bảo toàn Na : nNaOH bđ = 0,3 mol = 0,2.(x + x + x) => x = 0,5 (M)
=> nCl2 = ½ (nNaCl + nNaClO) = 0,2 mol => VCl2 = 4,48 lít
+) TH2 : sau phản ứng chỉ có NaCl ; NaClO có cùng nồng độ mol là y (M)
Bảo toàn Na : nNaOH bđ = 0,3 mol = 0,2.(y + y) => y = 0,75 (M)
=> nCl2 = ½ (nNaCl + nNaClO) = 0,15 mol => VCl2 = 3,36 lít
Câu 6: Phương pháp điều chế nước gia – ven trong PTN là
A. cho khí clo tác dụng với dung dịch NaOH ở nhiệt độ thường.
B. cho khí clo tác dụng với dung dịch NaOH ở 900C.
C. cho khí clo tác dụng với nước ở nhiệt độ thường.
D. điện phân dung dịch NaCl có màng ngăn.
Lời giải:
Đáp án: A
Phương pháp điều chế nước gia – ven trong PTN là cho khí clo tác dụng với dung dịch NaOH ở nhiệt độ thường.
Xem thêm các phương trình hóa học hay khác:
SO2 + NaOH → Na2SO3 + H2O l SO2 ra Na2SO3
CO2 + NaOH → Na2CO3 + H2O | NaOH ra Na2CO3
KOH + Cl2 → KCl + KClO + H2O | KOH ra KCl | KOH ra KClO | Cl2 ra KCl | Cl2 ra KClO




