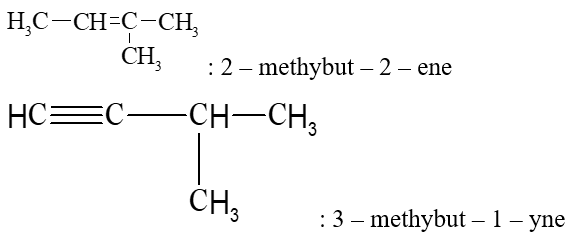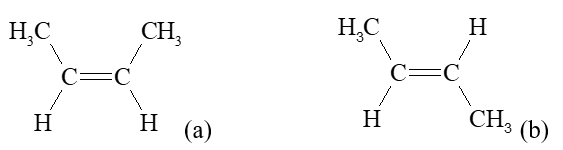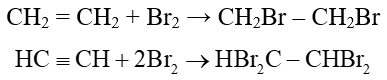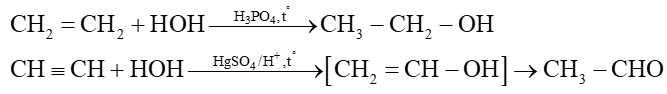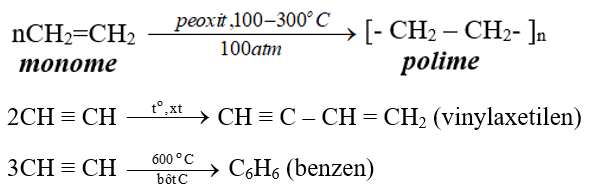Lý thuyết Hóa 11 Bài 13: Hydrocarbon không no
A. Lý thuyết
I. Khái niệm về alkene, alkyne
- Alkene là những hydrocarbon mạch hở, chỉ chứa các liên kết đơn và một liên kết đôi C = C trong phân tử, có công thức chung CnH2n (n ≥ 2).
Ví dụ: Ethene CH2 = CH2, propene CH2 = CH – CH3,….
- Alkyne là những hydrocarbon mạch hở, chỉ chứa các liên kết đơn và một liên kết ba C≡C trong phân tử, có công thức chung CnH2n-2 (n ≥ 2)
Ví dụ: Ethyne CH≡CH, propyne CH≡C−CH3,….
- Phân tử alkene và alkyne chứa liên kết π kém bền hơn liên kết σ.
Ví dụ: Đặc điểm liên kết, hình dạng phân tử của ethylene và acetylene
+ Trong phân tử ethylene, 2 nguyên tử carbon chứa liên kết đôi cùng 4 nguyên tử hydrogen đều nằm trên một mặt phẳng
+ Trong phân tử acetylene, 2 nguyên tử carbon chứa liên kết ba cùng 2 nguyên tử hydrogen đều nằm trên một được thẳng.
II. Danh pháp alkene và alkyne
- Tên theo danh pháp thay thế của alkene hoặc alkyne không phân nhánh
|
Tiền tố ứng với số nguyên tử carbon trong phân tử |
- Số chỉ vị trí liên kết bội (nếu số C ≥ 4) |
- ene (với alkene) yne (với alkyne) |
Ví dụ:
CH2 = CH – CH2 – CH3: But – 1 – ene
CH3−C≡C−CH3: But – 2 – yne
- Tên theo danh pháp thay thế của alkene phân nhánh
|
Số chỉ vị trí nhánh – Tên nhánh |
- Tiền tố ứng với số nguyên tử carbon của mạch chính |
- Số chỉ vị trí liên kết bội (nếu số C ≥ 4) |
- ene (với alkene) yne (với alkyne) |
Ví dụ:
III. Đồng phân hình học
- Với các phân tử alkene có từ 4 nguyên tử carbon trở lên, nếu mỗi nguyên tử carbon của liên kết đôi liên kết với hai nguyên tử, nhóm nguyên tử khác nhau sẽ có hai cách phân bố không gian. Đồng phân cis- của alkene có mạch chính nằm ở cùng phía của liên kết đôi, đồng phân trans- có mạch chính nằm ở hai phía của liên kết đôi.
Ví dụ:
Alkene (a) và alkene (b) là đồng phân cis-, trans- của nhau
IV. Tính chất vật lí
- Nhiệt độ nóng chảy, nhiệt độ sôi và khối lượng riêng của các alkene và alkyne nói chung biến đổi tương tự với alkane tương ứng. Alkene và alkyne không tan trong nước, nhẹ hơn nước, chỉ tan trong các dung môi hữu cơ không phân cực.
V. Tính chất hoá học
- Do đều chứa liên kết π kém bền trong phân tử, alkene và alkyne có phản ứng đặc trưng là phản ứng cộng.
- Alkene và alkyne đều có khả năng tham gia phản ứng cộng với H2, X2, HX, H2O, … (X là Cl, Br).
1. Phản ứng cộng
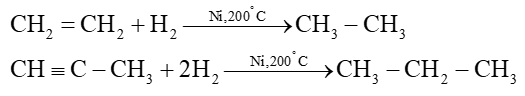
a) Cộng hydrogen
Ví dụ:
Phản ứng của alkyne xảy ra qua 2 giai đoạn, nếu dùng xúc tác Lindar, phản ứng chỉ dừng ở giai đoạn tạo alkene. Ví dụ: CH≡CH+H2→Lindar,t°
b) Cộng halogen
Ví dụ:
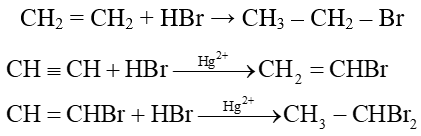
c) Cộng hydrogen halide (HX)
Alkene dễ phản ứng với hydrogen halide hơn so với alkyne
Ví dụ:
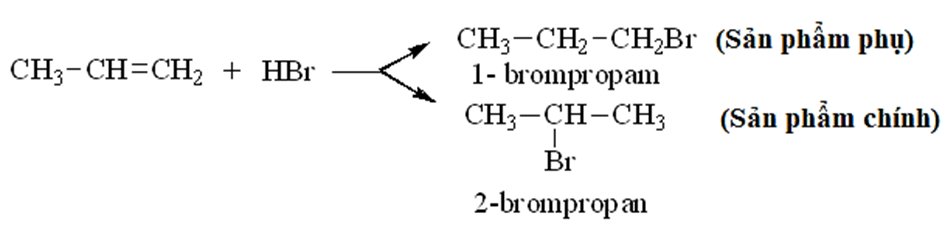
Alkene hoặc alkyne không đối xứng tác dụng với HX tạo thành hỗn hợp sản phẩm, trong đó sản phẩm chính tuân theo quy tắc Markovnikov: “Nguyên tử hydrogen ưu tiên cộng vào nguyên tử carbon chưa no có nhiều hydrogen hơn, còn nguyên tử X ưu tiên cộng vào nguyên tử carbon chưa no có ít hydrogen hơn”.
Ví dụ:
d) Cộng nước (hydrate hoá)
2. Phản ứng trùng hợp
Ở điều kiện thích hợp, các alkene có khả năng tham gia phản ứng trùng hợp tạo polymer.
3. Phản ứng oxi hoá
Các alkene và alkyne đều bị oxi hoá bởi dung dịch KMnO4 ở điều kiện thường, khi cháy toả nhiều nhiệt.
3CH2=CH2 + 4H2O + 2KMnO4 → 3HO–CH2–CH2–OH + 2MnO2↓ + 2KOH
3C2H2 + 8KMnO4 → 3KOOC–COOK + 8MnO2↓ + 2KOH + 2H2O
4. Phản ứng của riêng alk – 1 – yne
Các alk – 1 – yne như ethyne, propyne,… có phản ứng tạo kết tủa với dung dịch AgNO3 trong ammonia. Đây là phản ứng thường dùng để nhận biết alk – 1 – yne.
Ví dụ:
(màu vàng nhạt)
VI. Ứng dụng và cách điều chế alkene, alkyne
- Alkene được sử dụng làm nguyên liệu tổng hợp các chất hữu cơ khác nhau trong đời sống như polyethylene (PE), PP, ethylene glycol, acetone,…
- Acetylene được sử dụng làm nhiên liệu trong hàn, cắt kim loại. Alkyne cũng là nguyên liệu tổng hợp nên các chất hữu cơ khác nhau như polyeste, polyurethane, cao su neoprene,…
- Điều chế trong phòng thí nghiệm:
+ Alkene được điều chế bằng cách dehydrate alcohol no, đơn chức, mạch hở tương ứng.
Ví dụ:
+ Acetylene được điều chế bằng cách cho đất đèn (chứa calcium carbide) tác dụng với nước: CaC2 + 2H2O → C2H2 + Ca(OH)2
- Điều chế trong công nghiệp:
+ Alkene thu được từ quá trình cracking alkane
+ Acetylene được điều chế từ CaC2 hoặc từ CH4
B. Bài tập
Đang cập nhật......
Xem thêm các bài tóm tắt lý thuyết Hóa 11 Chân trời sáng tạo hay, chi tiết khác:
Lý thuyết Bài 11: Cấu tạo hóa học hợp chất hữu cơ
Lý thuyết Bài 14: Arene (Hydrocarbon thơm)