Trắc nghiệm Hóa học 11 KNTT Ôn tập chương 2 có đáp án
Trắc nghiệm Hóa học 11 KNTT Ôn tập chương 2 có đáp án
-
68 lượt thi
-
15 câu hỏi
-
0 phút
Danh sách câu hỏi
Câu 1:
Trong phản ứng:
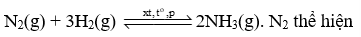
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Trong phản ứng: 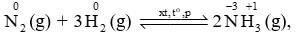 thể hiện tính oxi hóa, H2 thể hiện tính khử.
thể hiện tính oxi hóa, H2 thể hiện tính khử.
Câu 2:
Trong phản ứng tổng hợp ammonia:
N2(g) + 3H2(g) 2NH3(g) \[{\Delta _r}H_{298}^o\] = - 92 kJ
Để tăng hiệu suất phản ứng tổng hợp phải
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Để tăng hiệu suất phản ứng tổng hợp phải giảm nhiệt độ vừa phải và tăng áp suất.
Câu 3:
Cho 9,916 lít N2 (đkc) tác dụng với 22,311 lít H2 (đkc), thu được 3,4 gam NH3. Hiệu suất của phản ứng là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
\[{n_{{N_2}}} = \frac{{9,916}}{{24,79}} = 0,4(mol);{n_{{H_2}}} = \frac{{22,311}}{{24,79}} = 0,9(mol)\]; \[{n_{N{H_3}}} = \frac{{3,4}}{{17}} = 0,2(mol)\]
PTHH: N2(g) + 3H2(g) 2NH3(g)
So sánh: \[\frac{{0,4}}{1} > \frac{{0,9}}{3}\]→ Hiệu suất tính theo số mol của H2
Theo PTHH: \[{n_{{H_2}}}\]phản ứng = \[\frac{3}{2}{n_{N{H_3}}} = \frac{3}{2}.0,2 = 0,3(mol)\]
Vậy \[H = \frac{{0,3}}{{0,9}}.100 = 33,3\% \]
Câu 4:
Phân tử ammonia có dạng hình học nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Phân tử ammonia có dạng chóp tam giác.
Câu 5:
Trong ammonia, nitrogen có số oxi hóa là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Trong ammonia\[\mathop N\limits^{ - 3} \mathop {{H_3}}\limits^{ + 1} \], nitrogen có số oxi hóa là – 3.
Câu 6:
Ammonia đóng vai trò chất khử khi tác dụng với chất nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
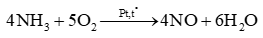
Ammonia đóng vai trò chất khử vì số oxi hoá tăng từ -3 lên + 2.
Câu 7:
Khi pha loãng dung dịch sulfuric acid đặc cần tuân thủ thao tác nào sau đây để đảm bảo an toàn?
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Khi pha loãng dung dịch sulfuric acid đặc cần tuân thủ thao tác: Rót từ từ acid vào nước để đảm bảo an toàn.
Câu 8:
Cho vài giọt dung dịch BaCl2 vào dung dịch nào sau đây sẽ tạo kết tủa trắng?
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
BaCl2 + H2SO4 → BaSO4↓trắng + 2HCl
Câu 9:
Cho chất rắn nào sau đây vào dung dịch H2SO4 đặc thì xảy ra phản ứng oxi hoá khử?
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
2KBr + 2H2SO4 K2SO4 + SO2 + Br2 + 2H2O
Câu 10:
Cho 7,2 gam kim loại M (hóa trị II) tác dụng hết với dung dịch HNO3 (dư), sinh ra 1,4874 lít khí N2 (sản phẩm khử duy nhất, ở đkc). Kim loại M là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
\[{n_{{N_2}}} = \frac{{1,4874}}{{24,79}} = 0,06(mol)\]
PTHH: 5M + 12HNO3 → 5M(NO3)2 + N2 + 6H2O
Theo phương trình: \[{n_M} = 5{n_{{N_2}}} = 5.0,06 = 0,3(mol)\]
→\[{M_M} = \frac{{7,2}}{{0,3}} = 24(g/mol)\]
Vậy M là magnesium (Mg.)
Câu 11:
Chia m gam hỗn hợp Cu, Al thành hai phần bằng nhau. Phần 1 cho tác dụng với HNO3 đặc, nguội dư thấy có 9,916 lít (ở đkc, là sản phẩm khử duy nhất) khí màu nâu đỏ thoát ra. Phần 2 cho vào dung dịch HCl thu được 7,437 lít khí (ở đkc). Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Phần 1 cho tác dụng với HNO3 đặc, nguội dư thấy có 9,916 lít (ở đkc, là sản phẩm khử duy nhất) khí màu nâu đỏ thoát ra là khí NO2 và chỉ có Cu phản ứng.
\[{n_{N{O_2}}} = \frac{{9,916}}{{24,79}} = 0,4(mol)\]
PTHH: Cu + 4HNO3 → Cu(NO3)2 + 2NO2 + 2H2O
Theo phương trình: \[{n_{Cu}} = \frac{1}{2}{n_{N{O_2}}} = 0,2(mol)\]→mCu = 0,2.64 = 12,8 (g)
Phần 2 cho vào dung dịch HCl thu được 7,437 lít khí H2 (ở đkc), chỉ có Al phản ứng
\[{n_{{H_2}}} = \frac{{7,437}}{{24,79}} = 0,3(mol)\]
PTHH: 2Al + 6HCl → 2AlCl3 + 3H2
Theo phương trình: \[{n_{Al}} = \frac{2}{3}{n_{{H_2}}} = \frac{2}{3}.0,3 = 0,2(mol)\]→mAl = 0,2.27 = 5,4 (g)
Vậy m = (12,8 + 5,4).2 = 36,4 (g).
Câu 12:
Cho 2,16 gam Mg tác dụng với dung dịch HNO3 (dư). Sau khi phản ứng xảy ra hoàn toàn thu được 0,9916 lít khí NO (ở đkc) và dung dịch X. Khối lượng muối khan thu được khi làm bay hơi dung dịch X là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
\[{n_{Mg}} = \frac{{2,16}}{{24}} = 0,09(mol);{n_{NO}} = \frac{{0,9916}}{{24,79}} = 0,04(mol)\]
Bảo toàn e, ta có:
\[2{n_{Mg}} = 3{n_{NO}} + 8{n_{N{H_4}N{O_3}}} \Rightarrow {n_{N{H_4}N{O_3}}} = \frac{{2.0,09 - 3.0,04}}{8} = 0,0075(mol)\]
Bảo toàn nguyên tố Mg: \[{n_{Mg{{(N{O_3})}_2}}} = {n_{Mg}} = 0,09(mol)\]
mmuối = \[{m_{Mg{{(N{O_3})}_2}}} + {m_{N{H_4}N{O_3}}} = 0,09.148 + 0,0075.80 = 13,92(g)\]
Câu 13:
Nung m gam bột sắt (iron) trong oxygen, thu được 3 gam hỗn hợp chất rắn X. Hòa tan hết hỗn hợp X trong dung dịch HNO3 (dư), thoát ra 0,61975 lít (ở đkc) NO (là sản phẩm khử duy nhất). Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
\[\begin{array}{l}\left\{ \begin{array}{l}Fe:x(mol)\\{O_2}:y(mol)\end{array} \right. \Rightarrow \left\{ \begin{array}{l}{m_X} = 56x + 32y = 3\\BTe:3x - 4y = 0,025.3\end{array} \right.\\ \Rightarrow \left\{ \begin{array}{l}x = 0,045(mol)\\y = 0,015(mol)\end{array} \right. \Rightarrow {m_{Fe}} = 56.0,045 = 2,52(g)\end{array}\]
Câu 14:
Hòa tan m gam Fe bằng dung dịch H2SO4 loãng, dư thu được 2,479 lít khí H2 (ở đkc). Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
\[{n_{{H_2}}} = \frac{{2,479}}{{24,79}} = 0,1(mol)\]
PTHH: Fe + H2SO4 → FeSO4 + H2
Theo phương trình: \[{n_{Fe}} = {n_{{H_2}}} = 0,1(mol) \to {m_{Fe}} = 0,1.56 = 5,6(g)\]
Câu 15:
Khi cho 9,6 gam Cu tác dụng với H2SO4 đặc, nóng, lấy dư. Thể tích khí SO2 thu được sau khi phản ứng xảy ra hoàn toàn ở (đkc) là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
\[{n_{Cu}} = \frac{{9,6}}{{64}} = 0,15(mol)\]
PTHH: Cu + 2H2SO4 → CuSO4 + SO2 + H2O
Theo phương trình: \[{n_{S{O_2}}} = {n_{Cu}} = 0,15(mol)\]
\[ \to {V_{S{O_2}}} = 0,15.24,79 = 3,7185(L)\]
