Giải Khoa học tự nhiên 7 Bài 7: Hóa trị và công thức hóa học
Video giải bài tập Khoa học tự nhiên 7 Bài 7: Hóa trị và công thức hóa học
Trả lời:
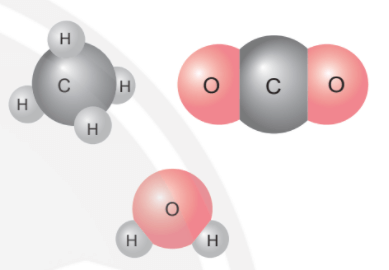
- Các nguyên tử liên kết với nhau theo đúng hóa trị.
- Để lập được công thức hóa học của một chất cần biết được thành phần nguyên tố và số lượng nguyên tử của mỗi nguyên tố đó trong hợp chất hoặc biết được thành phần nguyên tố và hóa trị của các nguyên tố đó trong hợp chất.
1. Hóa trị
Trả lời:
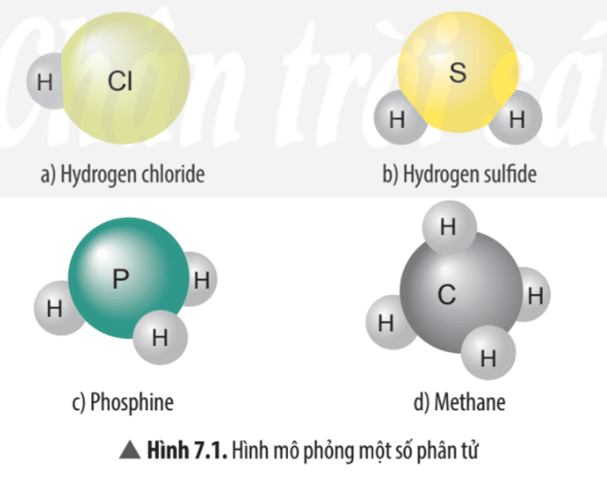
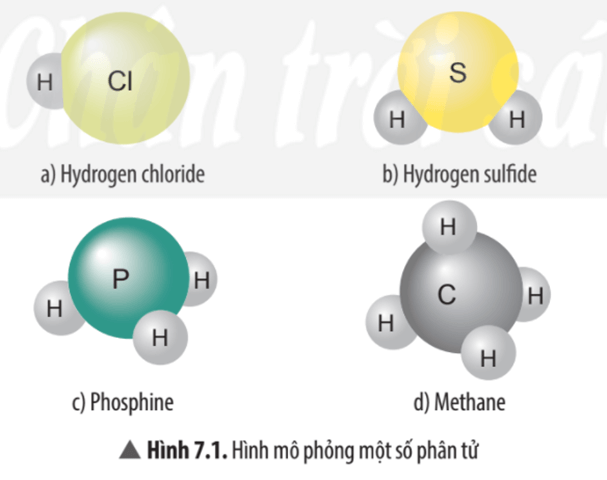
Hình 7.1 a) Nguyên tử Cl có khả năng liên kết với 1 nguyên tử H.
Hình 7.1 b) Nguyên tử S có khả năng liên kết với 2 nguyên tử H.
Hình 7.1 c) Nguyên tử P có khả năng liên kết với 3 nguyên tử H.
Hình 7.1 d) Nguyên tử C có khả năng liên kết với 4 nguyên tử H.
Trả lời:
- Trong phân tử hydrogen chloride nguyên tử Cl liên kết với 1 nguyên tử H vậy hóa trị của nguyên tử Cl bằng I.
- Trong phân tử hydrogen sulfide nguyên tử S liên kết với 2 nguyên tử H vậy hóa trị của nguyên tử S bằng II.
- Trong phân tử phosphine nguyên tử P liên kết với 3 nguyên tử H vậy hóa trị của nguyên tử P bằng III.
Trả lời:
Trong hợp chất silicon dioxide một nguyên tử Si có khả năng liên kết với 2 nguyên tử O (mỗi nguyên tử O hóa trị II) nên Si có hóa trị IV.
Ứng dụng của silicon dioxide:
- Dùng để sản xuất xi măng, nguyên liệu trong xây dựng…
- Làm kính phẳng, sản phẩm thủy tinh, sợi thủy tinh…
- Sản xuất đồ gốm;
- Sản xuất thạch anh dùng trong xử lí nước sạch;
- Sản xuất sodium silicate, dùng trong điều chế chất nhuộm màu, xà phòng.
Trả lời:
Theo cách xác định hóa trị của nguyên tố, 1 nguyên tử X có hóa trị IV có khả năng liên kết với 2 nguyên tử O (mỗi nguyên tử O có hóa trị II) hoặc 4 nguyên tử H (mỗi nguyên tử H có hóa trị I).
Ví dụ: Nguyên tố C hóa trị IV, có thể liên kết với 4 nguyên tử H để tạo thành phân tử methane và có thể liên kết với 2 nguyên tử O để tạo thành phân tử carbon dioxide.
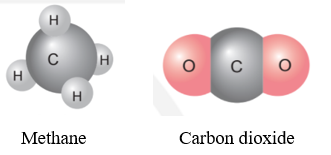
2. Quy tắc hóa trị
Trả lời:
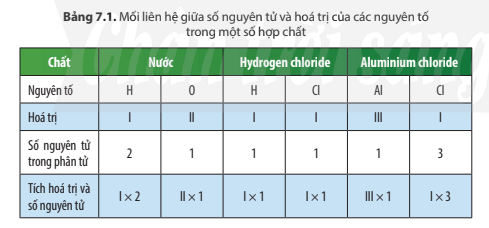
Dựa vào bảng 7.1, ta có:
Trong phân tử mỗi hợp chất, tích hóa trị và số nguyên tử của nguyên tố này bằng tích hóa trị và số nguyên tử của nguyên tố kia.
Trả lời:
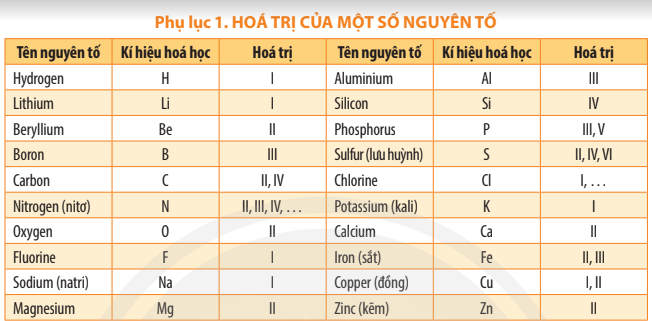
Dựa theo bảng Phụ lục 1 trang 187, Ca có hóa trị II nên Ca có thể kết hợp với 2 nguyên tử Cl (hóa trị I) hoặc 1 nguyên tử O (hóa trị II).
3. Công thức hóa học
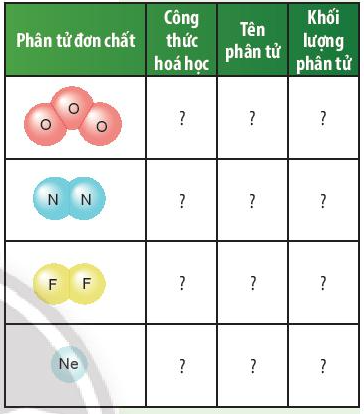
Câu hỏi thảo luận 4 trang 47 KHTN lớp 7: Dựa vào ví dụ 2, em hãy hoàn thành bảng sau:
Trả lời:
|
Công thức hóa học |
Tên phân tử |
Khối lượng phân tử |
|
|
|
O3 |
Ozone |
16 × 3 = 48 amu |
|
|
N2 |
Nitrogen |
14 × 2 = 28 amu |
|
|
F2 |
Fluorine |
19 × 2 = 38 amu |
|
|
Ne |
Neon |
20 amu |
Trả lời:
Đơn chất kim loại ở thể rắn: lithium (Li), sodium (Na), potassium (K), magnesium (Mg), aluminium (Al), iron (Fe), calcium (Ca), copper (Cu), gold (Au), silver (Ag), zinc (Zn),…
Đơn chất phi kim ở thể rắn: carbon (C), phosphorus (P), silicon (Si), sulfur (S), boron (B), iodine (I2),…
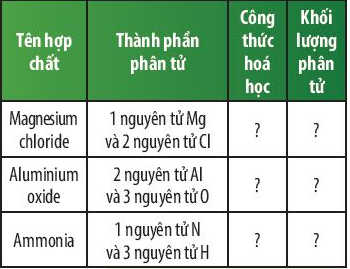
Câu hỏi thảo luận 6 trang 48 KHTN lớp 7: Em hãy hoàn thành bảng sau:
Trả lời:
|
Tên hợp chất |
Thành phần phân tử |
Công thức hóa học |
Khối lượng phân tử |
|
Magnesium chloride |
1 nguyên tử Mg và 2 nguyên tử Cl |
MgCl2 |
24 + 35,5 × 2 = 95 amu |
|
Aluminium oxide |
2 nguyên tử Al và 3 nguyên tử O |
Al2O3 |
27 × 2 + 16 × 3 = 102 amu |
|
Ammonia |
1 nguyên tử N và 3 nguyên tử H |
NH3 |
14 + 1 × 3 = 17 amu |
Trả lời:
- Iron(III) oxide được tạo thành từ 2 nguyên tố iron (Fe) và oxygen (O).
- Thành phần phân tử iron(III) oxide gồm 2 nguyên tử Fe và 3 nguyên tử O.
- Khối lượng phân tử bằng: 56 × 2 + 16 × 3 = 160 amu.
Trả lời:
Công thức hóa học cho biết: thành phần nguyên tố; tỉ lệ số nguyên tử của các nguyên tố; khối lượng phân tử của chất.
4. Tính phần trăm nguyên tố trong hợp chất
Trả lời:
- Hợp chất Al2O3 có:
%Al = = = 52,94%
%O = 100% - 52,94% = 47,06%
- Hợp chất MgCl2 có:
%Mg = = 25,26%
%Cl = 100% - 25,26% = 74,74%
- Hợp chất Na2S có:
%Na = = 58,97%
%S = 100% - 58,97% = 41,03%
- Hợp chất (NH4)2CO3 có:
%N = = 29,17%
%H = = 8,33%
%C = = 12,5%
%O = 100% - %N - %H - %C = 100% - 29,17% - 8,33% - 12,5% = 50%
Trả lời:
Công thức hóa học của phosphoric acid là: H3PO4
%H = .100% = 3,06%
%P = .100% = 31,63%
%O = 100% - 3,06% - 31,63% = 65,31%
⇒ Trong phosphoric acid nguyên tố có phần trăm lớn nhất là oxygen.
5. Xác định công thức hóa học
Trả lời:
Đặt công thức cần tìm của X là AlxCy.
%C = 100% - %Al = 100% - 75% = 25%
%Al = = 75%
⇒ x = 4
%C = = 25%
⇒ y = 3
Vậy công thức hóa học của hợp chất X là Al4C3
Trả lời:
Với hợp chất FexOy ta có:
%O = 100% - %Fe = 100% - 70% = 30%
%Fe = = 70%
⇒ x = 2
%O = = 30%
⇒ y = 3
Vậy công thức hóa học của hợp chất Y là Fe2O3.
Tìm hiểu qua sách, báo và internet, em hãy cho biết một số ứng dụng của hợp chất (Z).
Trả lời:
Đặt công thức hóa học của Z có dạng: KxNyOz. Trong Z có:
%K = = 38,61%
⇒ x = 1
%N = = 13,86%
⇒ y = 1
%O = = 47,535%
⇒ z = 3
Vậy công thức hóa học của hợp chất Z là KNO3.
Một số ứng dụng của KNO3:
- Chế tạo thuốc nổ.
- Trong nông nghiệp KNO3 được dùng để sản xuất phân bón (như phân kali, phân NPK …)
- Trong công nghiệp thực phẩm KNO3 được dùng làm chất phụ gia thực phẩm (E 252), KNO3 được xem là một trong những giải pháp tốt để bảo quản thịt chống ôi thiu, …
- Trong công nghiệp dược phẩm KNO3 được dùng để bào chế kem đánh răng dành cho răng nhạy cảm, thuốc làm giảm các triệu chứng hen suyễn và bệnh viêm khớp, …

KNO3
Câu hỏi thảo luận 11 trang 50 KHTN lớp 7: Dựa vào công thức (2), hãy tính hóa trị của nguyên tố
Trả lời:
a) Trong phân tử , ta có: a × 1 = I × 3 ⇒ a = III.
Vậy trong phân tử NH3 nguyên tố N có hóa trị III.
b) Trong phân tử , ta có: a × 1 = II × 2 ⇒ a = IV.
Vậy trong phân tử SO2 nguyên tố S có hóa trị IV.
Trong phân tử , ta có: a × 1 = II × 3 ⇒ a = VI.
Vậy trong phân tử SO3 nguyên tố S có hóa trị VI.
c) Trong phân tử , ta có: a × 2 = II × 5 ⇒ a = V
Vậy trong phân tử P2O5 nguyên tố P có hóa trị V.
Trả lời:
a) Công thức hóa học chung:
Theo quy tắc hóa trị ta có: x × I = y × II
Chuyển thành tỉ lệ:
Chọn x = 2; y = 1
Vậy công thức hóa học của hợp chất là K2SO4
b) Công thức hóa học chung:
Theo quy tắc hóa trị ta có: x × III = y × II
Chuyển thành tỉ lệ:
Chọn x = 2; y = 3
Vậy công thức hóa học của hợp chất là Al2(CO3)3
c) Công thức hóa học chung:
Theo quy tắc hóa trị ta có: x × II = y × I
Chuyển thành tỉ lệ:
Chọn x = 1; y = 2
Vậy công thức hóa học của hợp chất là Mg(NO3)2
Tìm hiểu thông qua sách, báo, internet và cho biết các ứng dụng của thạch cao.
Trả lời:
Xác định công thức hóa học của hợp chất M:
- Công thức hóa học chung của M:
- Theo quy tắc hóa trị ta có: x × II = y × II
- Chuyển thành tỉ lệ:
- Chọn x = 1; y = 1. Công thức hóa học của hợp chất M là CaSO4.
Một số ứng dụng của thạch cao:
- Trong xây dựng: làm vách ngăn, trang trí nội thất…
- Trong y tế: làm khung xương, bó bột …
- Trong mỹ thuật: đổ khuôn, đúc tượng …
Bài tập (trang 51)
Trả lời:
- Hợp chất tạo bởi oxygen và potassium có dạng:
Theo quy tắc hóa trị ta có: x × I = y × II
Chuyển thành tỉ lệ:
Chọn x = 2; y = 1
Vậy công thức hóa học của hợp chất là K2O
- Hợp chất tạo bởi oxygen và magnesium có dạng:
Theo quy tắc hóa trị ta có: x × II = y × II
Chuyển thành tỉ lệ:
Chọn x = 1; y = 1
Vậy công thức hóa học của hợp chất là MgO
- Hợp chất tạo bởi oxygen và aluminium có dạng:
Theo quy tắc hóa trị ta có: x × III = y × II
Chuyển thành tỉ lệ:
Chọn x = 2; y = 3
Vậy công thức hóa học của hợp chất là Al2O3
- Hợp chất tạo bởi oxygen và phosphorus có dạng:
Theo quy tắc hóa trị ta có: x × V = y × II
Chuyển thành tỉ lệ:
Chọn x = 2; y = 5
Vậy công thức hóa học của hợp chất là P2O5
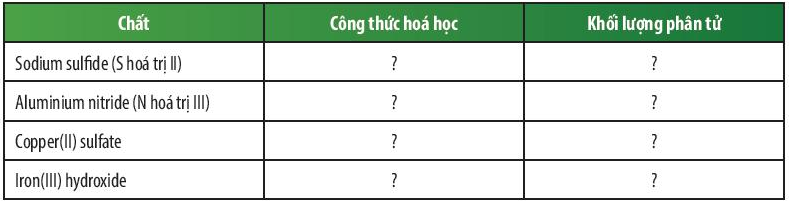
Bài 2 trang 51 KHTN lớp 7: Dựa vào bảng hóa trị ở Phụ lục trang 187, em hãy hoàn thành bảng sau:
Trả lời:
|
Chất |
Công thức hóa học |
Khối lượng phân tử |
|
Sodium sulfide (S hóa trị II) |
Na2S |
23 × 2 + 32 = 78 amu |
|
Aluminium nitride (N hóa trị III) |
AlN |
27 + 14 = 41 amu |
|
Copper(II) sulfate |
CuSO4 |
64 + 32 + 16 × 4 = 160 amu |
|
Iron(III) hydroxide |
Fe(OH)3 |
56 + 16 × 3 + 1 × 3 = 107 amu |
Trả lời:
Hợp chất T có công thức cần tìm là CaxCyOz.
%Ca = = 40%
⇒ x = 1
%C = = 12%
⇒ y = 1
%O = = 48%
⇒ z = 3
Vậy công thức hóa học của hợp chất là CaCO3
Xem thêm lời giải bài tập Khoa học tự nhiên lớp 7 Chân trời sáng tạo hay, chi tiết khác:
Bài 5: Phân tử - Đơn chất – Hợp chất
Bài 6: Giới thiệu về liên kết hóa học