Giải Khoa học tự nhiên 7 Bài 6: Hóa trị, công thức hóa học
Bài giảng Khoa học tự nhiên 7 Bài 6: Hóa trị, công thức hóa học
Trả lời:
Mỗi nguyên tử C có thể ghép tối đa với 4 nguyên tử H tạo thành hợp chất là CH4.
Mỗi nguyên tử O có thể ghép tối đa với 2 nguyên tử H tạo thành hợp chất là H2O
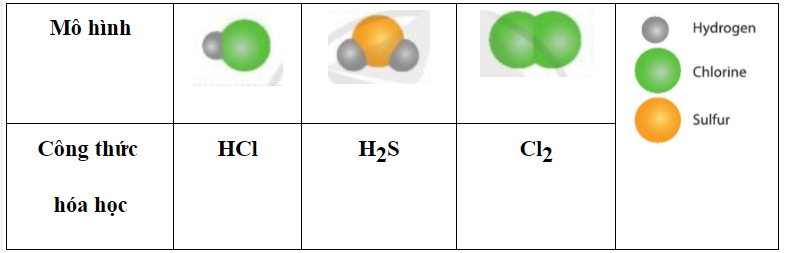
Mỗi nguyên tử Cl có thể ghép tối đa với 1 nguyên tử H tạo thành hợp chất HCl.
I. Hóa trị
Trả lời:
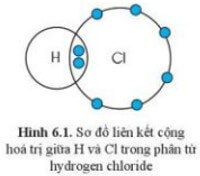
Quan sát sơ đồ thấy nguyên tử H và Cl, mỗi nguyên tử góp 1 electron.
Hóa trị của H và Cl đều là I, bằng với số electron mà nguyên tử H và Cl góp chung để tạo ra liên kết.
Trả lời:
Quan sát vào sơ đồ trên ta thấy:
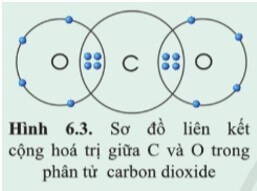
- Mỗi nguyên tử O góp chung 2 electron ⇒ O có hóa trị II.
- Nguyên tử C góp chung 4 electron để hình thành liên kết ⇒ C có hóa trị IV.
Trả lời:
- Sơ đồ hình thành liên kết giữa nguyên tử N và ba nguyên tử H:
- Liên kết giữa N và H được tạo thành bởi đôi electron dùng chung giữa hai nguyên tử
nên là liên kết cộng hóa trị.
+ Nguyên tử N góp 3 electron ⇒ N có hóa trị III.
+ Nguyên tử H góp chung 1 electron ⇒ H có hóa trị I.
Trả lời:
|
Nguyên tố |
Si |
O |
|
Hóa trị |
IV |
II |
|
Số nguyên tử |
1 |
2 |
|
Tích hóa trị và số nguyên tử |
IV × 1 = II × 2 |
|
Tích của hóa trị và số nguyên tử tham gia liên kết của Si và O bằng nhau.
Trả lời:
|
Nguyên tố |
Mg |
Cl |
|
Hóa trị |
II |
I |
|
Số nguyên tử |
1 |
y |
|
Tích hóa trị và số nguyên tử |
II × 1 = I × y |
|
Ta có: II × 1 = I × y ⇒ y = 2
Vậy mỗi nguyên tử Mg có thể kết hợp được với 2 nguyên tử Cl.
Trả lời:
|
Nguyên tố |
A |
B |
|
Hóa trị |
III |
II |
|
Số nguyên tử |
x |
y |
|
Tích hóa trị và số nguyên tử |
III × x = II × y |
|
Ta có: III × x = II × y ⟺
Vậy tỉ lệ nguyên tử của A và B trong hợp chất tạo thành từ hai nguyên tố đó là 2 : 3
II. Công thức hóa học
Câu hỏi 3 trang 41 KHTN lớp 7: Cho công thức hóa học của một số chất như sau:
Xác định nguyên tố tạo thành mỗi chất và số nguyên tử của mỗi nguyên tố có trong phân tử.
Trả lời:
a) N2 (nitrogen):
+ Nitrogen được tạo thành từ nguyên tố N.
+ Phân tử N2 có 2 nguyên tử N.
b) NaCl (sodium chloride):
+ Sodium chloride được tạo thành từ hai nguyên tố là Na và Cl.
+ Trong phân tử NaCl có 1 nguyên tử Na và 1 nguyên tử Cl.
c) MgSO4 (magnesium sulfate):
+ Magnesium sulfate được tạo thành từ 3 nguyên tố là Mg, S và O.
+ Trong phân tử MgSO4 có 1 nguyên tử Mg, 1 nguyên tử S và 4 nguyên tử O.
Luyện tập 5 trang 42 KHTN lớp 7: Viết công thức hóa học của các chất:
a) Sodium sulfide, biết trong phân tử có hai nguyên tử Na và một nguyên tử S.
b) Phosphoric acid, biết trong phân tử có ba nguyên tử H, một nguyên tử P và bốn nguyên tử O.
Trả lời:
a) Sodium sulfide: Na2S
b) Phosphoric acid: H3PO4
|
|
||||
Trả lời:
a) Glucose được tạo thành từ những nguyên tố nào?
b) Khối lượng mỗi nguyên tố trong một phân tử glucose bằng bao nhiêu?
c) Khối lượng phân tử glucose là bao nhiêu?
Trả lời:
a) Glucose được tạo thành từ ba nguyên tố là C, H, O.
b) Trong một phân tử glucose:
Khối lượng nguyên tố C là 6 × 12 = 72 amu
Khối lượng nguyên tố H là 12 × 1 = 12 amu
Khối lượng nguyên tố O là 6 × 16 = 96 amu
c) Khối lượng phân tử của glucose là: 72 + 12 + 96 = 180 amu.
Trả lời:
Ý kiến cho rằng: “Trong nước, số nguyên tử H gấp hai lần số nguyên tử O nên phần trăm khối lượng của H trong nước gấp hai lần phần trăm khối lượng của O” là không đúng.
Chứng minh:
Tính phần trăm khối lượng của H, O trong H2O
Khối lượng của nguyên tố H trong H2O là: 2 × 1 = 2 (amu)
Khối lượng của nguyên tố O trong H2O là: 1 × 16 = 16 (amu)
⇒ Khối lượng phân tử H2O là: 2 + 16 = 18 (amu)
Phần trăm về khối lượng của H trong H2O là:
%mH =
Phần trăm về khối lượng của O trong H2O là:
%mO = = = 88,89%
Vậy ý kiến cho rằng: “Trong nước, số nguyên tử H gấp hai lần số nguyên tử O nên phần trăm khối lượng của H trong nước gấp hai lần phần trăm khối lượng của O” là không đúng.
Trả lời:
Khối lượng của nguyên tố Ca trong CaCO3 là:
mCa = 1 × 40 amu = 40 amu
Khối lượng của nguyên tố C trong CaCO3 là:
mC = 1 × 12 amu = 12 amu
Khối lượng của nguyên tố O trong CaCO3 là:
mO = 3 × 16 = 48 amu
→ Khối lượng phân tử CaCO3 là: = 40 + 12 + 48 = 100 amu
Phần trăm về khối lượng của Ca trong CaCO3 là:
%mCa =
Phần trăm về khối lượng của C trong CaCO3 là:
%mC = = = 12%
Phần trăm về khối lượng của O trong CaCO3 là:
%mO =
Trả lời:
Khối lượng của nguyên tố C trong C6H8O7 là:
6 × 12 = 72 (amu)
Khối lượng của nguyên tố H trong C6H8O7 là:
8 × 1 = 8 (amu)
Khối lượng của nguyên tố O trong C6H8O7 là:
7 × 16 = 112 (amu)
⇒ Khối lượng phân tử C6H8O7 là: 72 + 8 + 112 = 192 (amu)
Phần trăm về khối lượng của C trong C6H8O7 là:
%mC =
Phần trăm về khối lượng của H trong C6H8O7 là:
%mH = × 100% = × 100% = 4,17%
Phần trăm về khối lượng của O trong C6H8O7 là:
%mO =
Trả lời:
- Xét hợp chất KCl ta có:
Khối lượng K trong hợp chất KCl là:
mK = 1 × 39 amu = 39 amu
Khối lượng phân tử hợp chất KCl là:
MKCl = 1 × 39 + 1 × 35,5 = 74,5 amu
Phần trăm khối lượng của K trong hợp chất KCl là:
%mK = = = 52,35%
- Xét hợp chất K2SO4 ta có:
Khối lượng K trong hợp chất K2SO4 là
mK = 2 × 39 amu = 78 amu
Khối lượng phân tử hợp chất K2SO4 là
= 2 × 39 amu + 1 × 32 amu + 4 × 16 amu = 174 amu
Phần trăm khối lượng của K trong hợp chất K2SO4 là
%mK = = = 44,83%
Vậy người trồng cây muốn sử dụng loại phân bón có hàm lượng K cao hơn nên dùng phân KCl.
Trả lời:
+ Xét hợp chất HBr
Gọi hóa trị của Br trong hợp chất là a.
Vì H có hóa trị I nên ta có biểu thức:
I × 1 = a × 1 ⇒ a = I
Vậy trong hợp chất HBr: hóa trị của H là I, hóa trị của Br là I.
+ Xét hợp chất BaO
Gọi hóa trị của Ba trong hợp chất là b
Vì O có hóa trị II nên ta có biểu thức:
b × 1 = II × 1 ⇒ b = II
Vậy trong hợp chất BaO, hóa trị của Ba là II, hóa trị của O là II.
Trả lời:
Đặt công thức hóa học của X là FexOy
Khối lượng nguyên tố Fe trong một phân tử X là
(amu)
Khối lượng của nguyên tố S trong một phân tử X là
160 – 112 = 48 (amu)
Ta có: 56 amu × x = 112 amu → x = 2
16 amu × y = 48 amu → y = 3
Vậy công thức hóa học của X là Fe2O3
Xem thêm lời giải bài tập Khoa học tự nhiên lớp 7 Cánh diều hay, chi tiết khác:
Bài 4: Phân tử, đơn chất, hợp chất