Giải Hóa học 10 Bài 9: Ôn tập chương 2
I. Hệ thống hóa kiến thức
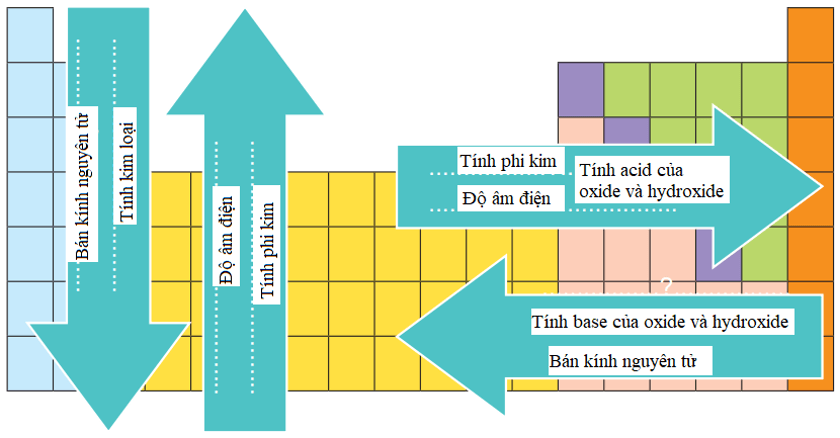
1. Cấu tạo bảng tuần hoàn
a)
- Điện tích hạt nhân tăng dần.
- Cùng số lớp electron ⇒ cùng chu kì (hàng).
- Cùng số electron hóa trị ⇒ cùng nhóm (cột).
b) Trong bảng tuần hoàn hiện nay có 118 nguyên tố, 7 chu kì, 18 cột (8 cột nhóm A và 10 cột nhóm B) chia thành 8 nhóm A (IA đến VIIIA) và 8 nhóm B (IB đến VIIIB). Mỗi nhóm là 1 cột, riêng nhóm VIIIB gồm 3 cột.
2. Xu hướng biến đổi trong bảng tuần hoàn
3. Bảng tuần hoàn và cấu tạo nguyên tử
Số Z = số proton = số electron = số hiệu nguyên tử
Số lớp electron = số thứ tự chu kì
Số electron lớp ngoài cùng = số thứ tự nhóm A
4. Định luật tuần hoàn
Tính chất của các nguyên tố và đơn chất cũng như thành phần và tính chất của các hợp chất tạo nên từ các nguyên tố đó biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên tử.
II. Luyện tập (trang 46, 47)
Có các nhận xét sau:
(1) Thứ tự giảm dần tính kim loại là Y, E, X.
(2) Thứ tự tăng dần độ âm điện là Y, X, T.
(3) Thứ tự tăng dần tính phi kim là T, Q.
(4) Thứ tự giảm dần bán kính nguyên tử Y, E, X, T.
Số nhận xét đúng là
A. 1. B. 2.
C. 3. D. 4.
Lời giải:
Đáp án C
(1) Đúng vì trong một chu kì tính kim loại giảm theo chiều tăng của điện tích hạt nhân nguyên tử.
(2) Đúng vì theo chiều tăng của điện tích hạt nhân nguyên tử: trong một chu kì độ âm điện tăng dần.
⇒ Thứ tự tăng dần độ âm điện là Y, X, T.
(3) Sai vì trong một nhóm tính phi kim giảm dần theo chiều tăng của điện tích hạt nhân nguyên tử.
⇒ Thứ tự tăng dần tính phi kim là Q, T.
(4) Đúng vì trong 1 chu kì bán kính nguyên tử giảm dần theo chiều tăng của điện tích hạt nhân nguyên tử.
⇒ Thứ tự giảm dần bán kính nguyên tử là Y, E, X, T.
(1) Nguyên tử S có 3 lớp electron và có 10 electron p.
(2) Nguyên tử S có 5 electron hóa trị và 6 electron s.
(3) Công thức oxide cao nhất của S có dạng là SO3 và là acidic oxide.
(4) Nguyên tố S có tính phi kim mạnh hơn so với nguyên tố có số hiệu nguyên tử là 8.
(5) Hydroxide cao nhất của S có dạng H2SO4 và có tính acid.
Số phát biểu đúng là
A. 2. B. 3.
C. 4. D. 5.
Lời giải:
Đáp án B
Sulfur (S) là nguyên tố thuộc nhóm VIA, chu kì 3 của bảng tuần hoàn.
⇒ Nguyên tử S có 3 lớp electron và có 6 electron lớp ngoài cùng.
⇒ Cấu hình electron của nguyên tử S là 1s2 2s2 2p6 3s2 3p4.
⇒ Nguyên tử S có 6 electron hóa trị, 6 electron s, 10 electron p.
⇒ (1) đúng, (2) sai.
Oxide cao nhất có dạng SO3 và là acidic oxide ⇒ (3) đúng
Nguyên tố S có tính phi phim yếu hơn nguyên tố có số hiệu nguyên tử là 8 vì trong một nhóm theo chiều tăng dần điện tích hạt nhân thì tính phi kim giảm dần.
⇒ (4) sai
Hydroxide cao nhất của S có dạng H2SO4 và có tính acid mạnh.
⇒ (5) đúng
(1) X và Y thuộc 2 nhóm A kế tiếp nhau.
(2) X là kim loại. Y là phi kim.
(3) XO là basic oxide và YO3 là acidic oxide.
(4) Hydroxide cao nhất của Y có dạng Y(OH)6 và có tính base
Số phát biểu đúng là
A. 2. B 3.
C. 4 D. 1
Lời giải:
Đáp án A
- Oxide cao nhất của X và Y có dạng là XO và YO3.
⇒ X thuộc nhóm IIA, Y thuộc nhóm VIA (vậy (1) sai)
⇒ X là kim loại, Y là phi kim (vậy (2) đúng)
- XO là basic oxide và YO3 là acidic oxide (vậy (3) đúng)
⇒ Hydroxide cao nhất của Y có dạng H2XO4 và có tính acid (vậy (4) sai)
⇒ Có 2 phát biểu (2) và (3) đúng.
a) Nêu vị trí trong bảng tuần hoàn của mỗi nguyên tố có trong thành phần của borax và viết cấu hình electron của nguyên tử các nguyên tố đó.
b) Sắp xếp các nguyên tố trên (trừ H) theo chiều bán kính nguyên tử tăng dần và giải thích.
c) Sắp xếp các nguyên tố trên (trừ H) theo chiều độ âm điện giảm dần và giải thích.
Lời giải:
a) Từ công thức của borax là Na2B4O7.10H2O ta xác định được thành phần của borax gồm các nguyên tố sau: Na, B, O, H.
+ Nguyên tố Na nằm ở ô 11, chu kì 3, nhóm IA. Cấu hình electron của nguyên tử Na là 1s2 2s2 2p6 3s1.
+ Nguyên tố B nằm ở ô 5, chu kì 2, nhóm IIIA. Cấu hình electron của nguyên tử B là 1s2 2s22p1.
+ Nguyên tố O nằm ở ô 8, chu kì 2, nhóm VIA. Cấu hình electron của nguyên tử O là 1s2 2s2 2p4.
+ Nguyên tố H nằm ở ô 1, chu kì 1, nhóm IA. Cấu hình electron của nguyên tử H là 1s1.
b) Thứ tự bán kính nguyên tử tăng dần: O < B < Na.
Ta có: O và B thuộc cùng chu kì 2, theo quy luật biến đổi bán kính ta có bán kính O < B.
Na ở chu kì 3, có bán kính nguyên tử lớn hơn so với hai nguyên tử ở chu kì 2.
c) Thứ tự độ âm điện giảm dần: O > B > Na
Ta có: Trong một chu kì, độ âm điện tăng từ trái qua phải (theo chiều tăng của điện tích hạt nhân) nên độ âm điện: B < O và Na < Al.
Trong một nhóm, theo chiều tăng của điện tích hạt nhân (chiều từ trên xuống dưới) độ âm điện giảm nên độ âm điện: Al < B.
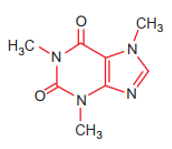
a) Nêu vị trí của các nguyên tố tạo nên cafein trong bảng tuần hoàn.
b) So sánh tính phi kim, bán kính nguyên tử và độ âm điện của các nguyên tố đó (trừ H) và giải thích.
Lời giải:
a) Từ công thức cấu tạo của cafein, xác định được các nguyên tố tạo nên cafein là C, N, O, H.
+ Nguyên tố C thuộc ô thứ 6, chu kì 2, nhóm IVA.
+ Nguyên tố N thuộc ô thứ 7, chu kì 2, nhóm VA.
+ Nguyên tố O thuộc ô thứ 8, chu kì 2, nhóm VIA.
+ Nguyên tố H thuộc ô thứ 1, chu kì 1, nhóm IA.
b)
- Các nguyên tố C, N, O cùng thuộc chu kì 2 nên:
+ Tính phi kim tăng dần C < N < O do trong 1 chu kì tính phi kim tăng dần từ trái qua phải.
+ Bán kính nguyên tử giảm C > N > O do trong 1 chu kì bán kính nguyên tử giảm từ trái qua phải.
+ Độ âm điện tăng dần C < N < O do trong 1 chu kì độ âm điện tăng dần từ trái sang phải.
a) Viết cấu hình electron, từ đó xác định vị trí của hai nguyên tố A và B trong bảng tuần hoàn.
b) So sánh tính chất hóa học của A với B và giải thích.
Lời giải:
a) Gọi số đơn vị điện tích hạt nhân của nguyên tố A là Z.
Hai nguyên tố A, B đứng kế tiếp nhau trong cùng một chu kì của bảng tuần hoàn nên số đơn vị điện tích hạt nhân của nguyên tố B là Z + 1.
Theo bài: Z + (Z + 1) = 25
⇒ Z = 12
⇒ Nguyên tử A có 12 electron, nguyên tử B có 13 electron.
⇒ Cấu hình electron của A là 1s2 2s2 2p6 3s2.
Cấu hình electron của B là 1s2 2s2 2p6 3s2 3p1.
⇒ Nguyên tố A (Mg) thuộc ô số 12, chu kì 3, nhóm IIA.
Nguyên tố B (Al) thuộc ô số 13, chu kì 3, nhóm IIIA.
b) Nguyên tử A có 2 electron lớp ngoài cùng nên A là kim loại.
Nguyên tử B có 3 electron lớp ngoài cùng nên B là kim loại.
Nguyên tố B kế tiếp nguyên tố A trong một chu kì nên tính kim loại A > B do trong một chu kì tính kim loại giảm từ trái sang phải.