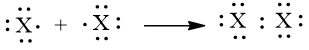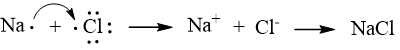Giải Hóa học 10 Bài 21: Nhóm halogen
Lời giải:
Trong tự nhiên, các halogen tồn tại ở dạng hợp chất vì các halogen có tính oxi hóa mạnh nên phản ứng với các chất trong tự nhiên tạo ra hợp chất.
I. Trạng thái tự nhiên
Câu hỏi 1 trang 105 Hóa học 10: Kể tên một số hợp chất phổ biến của halogen trong tự nhiên.
Lời giải:
Một số hợp chất phổ biến của halogen trong tự nhiên như calcium fluoride, sodium chloride, …
II. Cấu tạo nguyên tử, phân tử
|
Nguyên tử |
Lớp electron ngoài cùng |
Bán kính nguyên tử |
Độ âm điện |
|
Fluorine |
? |
? |
? |
|
Chlorine |
? |
? |
? |
|
Bromine |
? |
? |
? |
|
Iodine |
? |
? |
? |
Từ bảng số liệu thu được, hãy:
a) Giải thích tại sao nguyên tử halogen có xu hướng nhận 1 electron từ nguyên tử kim loại, hoặc góp chung 1 electron với nguyên tử phi kim, để hình thành liên kết.
b) Nêu và giải thích xu hướng biến đổi bán kính nguyên tử, độ âm điện của các nguyên tử halogen. Từ đó dự đoán xu hướng biến đổi tính oxi hoá từ F đến I.
c) Dựa vào cấu hình electron lớp ngoài cùng và độ âm điện, giải thích tại sao nguyên tử fluorine chỉ có số oxi hoá -1 trong các hợp chất?
Lời giải:
|
Nguyên tử |
Lớp electron ngoài cùng |
Bán kính nguyên tử |
Độ âm điện |
|
Fluorine |
7 |
72 pm |
3,98 |
|
Chlorine |
7 |
100 pm |
3,16 |
|
Bromine |
7 |
114 pm |
2,96 |
|
Iodine |
7 |
133 pm |
2,66 |
a) Nguyên tử halogen có 7 electron lớp ngoài cùng nên có xu hướng nhận 1 electron từ nguyên tử kim loại, hoặc góp chung 1 electron với nguyên tử phi kim, để hình thành liên kết, khi này các nguyên tử halogen đạt cấu hình electron bền vững của khí hiếm gần nó nhất.
Tổng quát: X + e → X-
b) Đi từ F – I, bán kính nguyên tử tăng dần vì lực hút giữa hạt nhân với các electron lớp ngoài cùng giảm.
Đi từ F – I, độ âm điện giảm dần vì số lớp electron tăng, lực hút giữa hạt nhân với các electron lớp ngoài cùng giảm.
⇒ Dự đoán: Tính oxi hóa giảm dần từ F > Cl > Br > I.
c) Nguyên tử fluorine có độ âm điện lớn nhất nên nguyên tử fluorine chỉ có xu hướng hút electron về mình. Mà lớp ngoài cùng có 7 electron nên nguyên tử fluorine sẽ nhận 1 electron về mình để đạt cấu hình electron bền vững của khí hiếm gần nó nhất (Ne).
⇒ Trong các hợp chất, fluorine chỉ có số oxi hóa là -1.
Hoạt động 2 trang 105 Hóa học 10: Tham khảo Bài 12 (Liên kết cộng hoá trị), hãy:
a) Mô tả sự hình thành liên kết trong phân tử halogen bằng công thức electron.
b) Liên kết trong phân tử halogen là liên kết cộng hoá trị phân cực hay không phân cực?
c) Dựa vào bán kính nguyên tử (Hình 6.2), hãy dự đoán xu hướng biến đổi độ dài liên kết trong dãy các phân tử halogen.
Lời giải:
a) Phân tử halogen: Mỗi nguyên tử halogen có 7 electron hoá trị, hai nguyên tử halogen liên kết với nhau bằng cách mỗi nguyên tử halogen góp 1 electron, tạo thành một cặp electron dùng chung. Khi đó, trong phân tử X2 (X: halogen), mỗi nguyên tử đều có 8 electron ở lớp ngoài cùng, thoả mãn quy tắc octet:
b) Liên kết trong phân tử halogen là liên kết cộng hoá trị không phân cực.
c) Bán kính tăng dần từ F < Cl < Br < I và độ âm điện giảm dần từ F > Cl > Br > I.
⇒ Dự đoán: độ dài liên kết X – X (X: halogen) tăng dần từ F2 đến I2.
Lời giải:
- Số oxi hóa của chlorine trong Cl2 là 0.
- Số oxi hóa của chlorine trong HCl là -1.
- Số oxi hóa của chlorine trong HClO là +1.
- Số oxi hóa của chlorine trong HClO2 là +3.
- Số oxi hóa của chlorine trong HClO3 là +5.
- Số oxi hóa của chlorine trong HClO4 là +7.
Lời giải:
Các mức oxi hóa của chlorine là: -1, 0, +1, +3, +5, +7.
Số oxi hóa của chlorine trong Cl2 là 0, đây là mức oxi hóa trung gian nên Cl2 vừa có tính oxi hóa vừa có tính khử.
Lời giải:
Một vài hợp chất của halogen thường được dùng trong thực tế là sodium chloride (NaCl), calcium flouride (CaF2), sodium hypochlorite (HClO), potassium chlorate (KClO3), sodium iodide (NaI), …
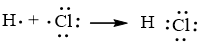
Mô tả sự hình thành liên kết trong phân tử NaCl và HCl để minh hoạ.
Lời giải:
Sự hình thành liên kết trong phân tử NaCl
Nguyên tử Na nhường 1 electron để tạo thành ion Na+ còn nguyên tử Cl nhận electron để trở thành ion Cl-. Các ion Na+ và Cl- sẽ hút nhau tạo thành liên kết ion.
Sự hình thành liên kết trong phân tử HCl
Nguyên tử hydrogen liên kết với nguyên tử chlorine bằng cách mỗi nguyên tử góp 1 electron tạo thành 1 cặp electron dùng chung trong phân tử HCl. Khi đó nguyên tử hydrogen có 2 electron (cấu hình electron bền vững của nguyên tử khí hiếm He) và nguyên tử chlorine có 8 electron lớp ngoài cùng, thoả mãn quy tắc octet.
III. Tính chất vật lí
Lời giải:
Nhiệt độ nóng chảy, nhiệt độ sôi tăng từ F2 đến I2 do:
- Tương tác van der Waals giữa các phân tử tăng.
- Khối lượng phân tử tăng.
IV. Tính chất hóa học
Lời giải:
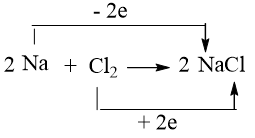
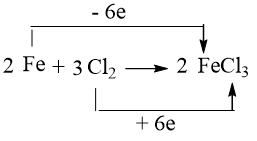
⇒ Na đóng vai trò là chất khử, còn Cl2 đóng vai trò là chất oxi hóa.
⇒ Fe đóng vai trò là chất khử, còn Cl2 đóng vai trò là chất oxi hóa.
Hoạt động trang 108 Hóa học 10: Xét các phản ứng hoá học: H2(g) + X2(g) → 2HX(g) (X là các halogen).
Tra số liệu trong Bảng 12.2 để:
1. Giải thích xu hướng phản ứng của các đơn chất halogen với hydrogen theo khả năng hoạt động của các halogen.
2. Dựa vào số liệu năng lượng liên kết H – X, giải thích xu hướng phản ứng giảm dần từ F2 đến I2.
Lời giải:
1. Từ fluorine đến iodine, tính oxi hóa giảm dần.
⇒ Khả năng phản ứng của các đơn chất halogen với hydrogen giảm dần.
2. Dựa vào bảng 12.2, năng lượng liên kết H – X giảm dần từ H – F đến H – I nên xu hướng phản ứng giảm dần từ F2 đến I2.
Lời giải:
Đổi 80 000m3 = 80 000 000 L = 8.107 L
5 mg Cl2 được dùng để khử trùng 1 L nước sinh hoạt.
x mg Cl2 được dùng để khử trùng 8.107 L nước sinh hoạt.
⇒ x = 8.107.51=4.108 mg = 400 kg
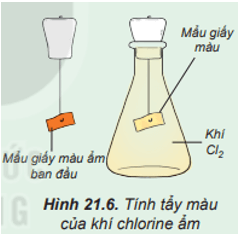
Hoạt động trang 109 Hóa học 10: Tìm hiểu tính tẩy màu của khí chlorine ẩm
Tiến hành:
Đính một mẩu giấy màu ẩm vào dây kim loại gắn với nút đậy bình tam giác. Sau đó, đưa mẩu giấy vào bình tam giác chứa khí chlorine (Hình 21.6).
Quan sát hiện tượng và thực hiện yêu cầu sau:
1. Nhận xét màu của mẩu giấy trước và sau khi cho vào bình tam giác. Giải thích.
2. Xác định vai trò của chlorine trong phản ứng với nước, tại sao nói chlorine tự oxi hoá - tự khử trong phản ứng này?
Lời giải:
1. Sau khi cho mẩu giấy màu ẩm vào bình tam giác thì mẩu giấy mất màu do một phần khí Cl2 tác dụng với nước sinh ra HClO có tính oxi hóa mạnh, có khả năng diệt khuẩn và tẩy màu.
Cl2 + H2O ⇌ HCl + HClO
2. Trong phản ứng của chlorine với nước thì chlorine vừa đóng vai trò là chất oxi hóa vừa đóng vai trò là chất khử.
Ta nói chlorine tự oxi hoá - tự khử trong phản ứng này vì trong phân tử chlorine có một nguyên tử Cl đóng vai trò là chất oxi hóa, một nguyên tử Cl đóng vai trò là chất khử.
Lập phương trình hoá học của phản ứng trên theo phương pháp thăng bằng electron, chỉ rõ chất oxi hoá, chất khử.
Lời giải:
Phản ứng: Cl2 + NaOH to→NaCl + NaClO3 + H2O
0Cl2+ NaOH→Na−1Cl + Na+5ClO3+H2O
⇒ Cl2 vừa đóng vai trò là chất khử vừa đóng vai trò là chất oxi hóa.
1×5×||0Cl→+5Cl +5e0Cl +e→−1Cl
⇒ Phương trình: 3Cl2 + 6NaOH to→5NaCl + NaClO3 + 3H2O
Hoạt động trang 110 Hóa học 10: Phản ứng thế của một số muối halide
Chuẩn bị: 3 ống nghiệm, dung dịch NaBr, dung dịch NaI, nước Cl2, nước Br2 loãng.
Tiến hành:
- Lấy khoảng 2 mL dung dịch NaBr vào ống nghiệm (1), 2 mL dung dịch NaI vào mỗi ống nghiệm (2) và (3).
- Thêm vào ống nghiệm (1) và (2) vài giọt nước Cl2, thêm vào ống (3) vài giọt nước Br2, lắc đều các ống nghiệm.
Lưu ý: Cẩn thận không để nước Cl2, nước Br2 giây ra tay, quần áo.
Quan sát sự thay đổi màu của dung dịch trong các ống nghiệm và trả lời câu hỏi:
1. Nhận xét sự thay đổi màu của dung dịch trong các ống nghiệm.
2. So sánh tính oxi hoá của Cl2, Br2, I2.
3. Hãy chọn một thuốc thử để chứng tỏ có sự tạo thành I2 khi cho nước chlorine (hoặc nước bromine) tác dụng với dung dịch sodium iodide.
Lời giải:
1. Ống nghiệm (1): dung dịch chuyển sang màu vàng.
Ống nghiệm (2): dung dịch có màu vàng và có chất rắn màu đen tím.
Ống nghiệm (3): dung dịch màu vàng nhạt dần và có chất rắn màu đen tím.
2. Tính oxi hóa của Clo mạnh hơn Brom nên Clo có thể đẩy ion Br– ra khỏi dung dịch muối.
Tính oxi hóa của Brom mạnh hơn Iot nên Brom có thể đẩy ion I– ra khỏi dung dịch muối.
⇒ Tính oxi hóa của Cl2 > Br2 > I2.
3. Để chứng tỏ có sự tạo thành I2 khi cho nước chlorine (hoặc nước bromine) tác dụng với dung dịch sodium iodide ta có thể dùng thuốc thử là hồ tinh bột vì I2 tạo màu xanh đặc trưng với hồ tinh bột.
Lời giải:
Phương trình minh họa tính oxi hóa giảm dần trong dãy Cl2, Br2, I2 là:
Cl2 + 2NaBr → 2NaCl + Br2
Br2 + 2NaI → 2NaBr + I2
V. Điều chế chlorine
Lời giải:
Nếu không sử dụng màng ngăn xốp để ngăn cách hai điện cực thì khí Cl2 ở cực dương sẽ phản ứng được với NaOH bên cực âm.
2NaOH + Cl2 → NaCl + NaClO + H2O
Sử dụng nước Javel an toàn.
Lời giải:
Thí nghiệm so sánh tính oxi hóa của đơn chất halogen
Chuẩn bị: 3 ống nghiệm, dung dịch NaBr, dung dịch NaI, nước Cl2, nước Br2 loãng.
Tiến hành:
- Lấy khoảng 2 mL dung dịch NaBr vào ống nghiệm (1), 2 mL dung dịch NaI vào mỗi ống nghiệm (2) và (3).
- Thêm vào ống nghiệm (1) và (2) vài giọt nước Cl2, thêm vào ống (3) vài giọt nước Br2, lắc đều các ống nghiệm.
- Thêm 1 giọt hồ tinh bột vào ống nghiệm (3).
Lưu ý: Cẩn thận không để nước Cl2, nước Br2 giây ra tay, quần áo.
⇒ Kết luận: Tính oxi hóa giảm dần từ Cl2, Br2, I2.
Cách sử dụng nước Javel an toàn:
- Dùng găng tay cao su khi sử dụng.
- Tránh để nước Javel tiếp xúc trực tiếp với da đặc biệt là mắt.
- Để ở xa tầm tay trẻ em.
Xem thêm lời giải bài tập SGK Hóa học lớp 10 Kết nối tri thức hay, chi tiết khác: