Giải Hóa học 10 Bài 3: Cấu trúc lớp vỏ electron nguyên tử
Lời giải:
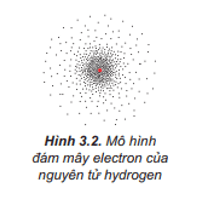
- Trong nguyên tử, các electron chuyển động rất nhanh, không theo quỹ đạo xác định.
- Trong nguyên tử, các electron sắp xếp thành từng lớp và phân lớp theo nguyên lí vững bền, nguyên lí Pauli và quy tắc Hund.
I. Chuyển động của electron trong nguyên tử
Lời giải:
Theo mô hình hiện đại, trong nguyên tử, electron chuyển động rất nhanh, không theo quỹ đạo xác định.
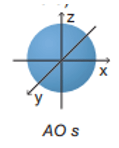
Câu hỏi 2 trang 22 Hóa học 10: Orbital s có dạng
A. hình tròn.
B. hình số tám nổi.
C. hình cầu.
D. hình bầu dục.
Lời giải:
Đáp án C
Các orbital s có dạng hình cầu.
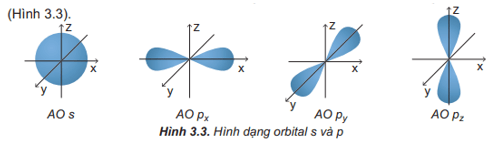
Câu hỏi 3 trang 22 Hóa học 10: Quan sát Hình 3.3 và nêu sự định hướng của các AO p trong không gian.
Lời giải:
- Orbital p có dạng hình số 8 nổi và có 3 sự định hướng:
+ Orbital px định hướng theo trục x.
+ Orbital py định hướng theo trục y.
+ Orbital pz định hướng theo trục z.
II. Lớp và phân lớp electron
Câu hỏi 4 trang 23 Hóa học 10: Hãy cho biết tổng số electron tối đa chứa trong:
a) Phân lớp p.
b) Phân lớp d.
Lời giải:
a) Tổng số electron tối đa chứa trong phân lớp p là 6.
b) Tổng số electron tối đa chứa trong phân lớp d là 10.
A. 2 và 8.
B. 8 và 10.
C. 8 và 18
D. 18 và 32.
Lời giải:
Đáp án C
- Lớp L (n = 2) có 2 phân lớp là 2s và 2p nên lớp L có tổng số electron tối đa là 8.
- Lớp M (n = 3) có 3 phân lớp là 3s, 3p, 3d nên lớp M có tổng số electron tối đa là 18.
III. Cấu hình electron của nguyên tử
Câu hỏi 6 trang 24 Hóa học 10: Cấu hình electron của nguyên tử có Z = 16 là
A. 1s22s22p63s23p3.
B. 1s22s22p63s23p5.
C. 1s22s22p63s23p4.
D. 1s22s22p63s23p6.
Lời giải:
Đáp án C
Nguyên tử có Z = 16 nên nguyên tử có 16 electron.
⇒ Cấu hình electron là 1s22s22p63s23p4.
Lời giải:
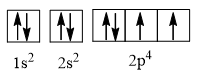
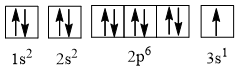
- Cấu hình electron của nguyên tử có Z = 8: 1s22s22p4, được biểu diễn theo ô orbital là:
- Cấu hình electron của nguyên tử có Z = 11: 1s22s22p63s1, được biểu diễn theo ô orbital là:
Lời giải:
Ta có: Z = 14 ⇒ Nguyên tử silicon có 14 electron.
- Viết thứ tự các lớp và phân lớp electron theo chiều tăng của năng lượng:
1s 2s 2p 3s 3p 4s …
- Điền các electron vào các phân lớp electron theo nguyên lí vững bền:
1s22s22p63s23p2.
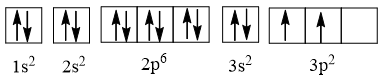
⇒ Cấu hình electron của nguyên tử silicon có Z = 14: 1s22s22p63s23p2, được biểu diễn theo ô orbital là:
Giải thích:
+ Theo nguyên lí Pauli: Các phân lớp 1s, 2s, 2p, 3s đều chứa tối đa các electron nên trong mỗi AO có 2 electron (kí hiệu ↑, ↓) có chiều quay ngược nhau được viết là ↑↓.
+ Theo quy tắc Hund: Phân lớp 3p chỉ có 2 electron nên các electron phải phân bố sao cho số electron độc thân là tối đa và các electron này có chiều tự quay giống nhau (↑).
Lời giải:
Chlorine có Z = 17 nên nguyên tử chlorine có 17 electron.
- Viết thứ tự các lớp và phân lớp electron theo chiều tăng của năng lượng:
1s 2s 2p 3s 3p 4s …
- Điền các electron vào các phân lớp electron theo nguyên lí vững bền:
1s22s22p63s23p5.
⇒ Cấu hình electron của nguyên tử chlorine là: 1s22s22p63s23p5.
⇒ Lớp ngoài cùng có 7 electron.
⇒ Chlorine là phi kim.
Lời giải:
- Cấu hình electron nguyên tử của nitrogen (Z = 7) là 1s22s22p3.
⇒ Lớp ngoài cùng có 5 electron.
⇒ Nitrogen là phi kim.
- Cấu hình electron nguyên tử của oxygen (Z = 8) là 1s22s22p4.
⇒ Lớp ngoài cùng có 6 electron.
⇒ Oxygen là phi kim.
- Cấu hình electron nguyên tử của aluminium (Z = 13) là 1s22s22p63s23p1.
⇒ Lớp ngoài cùng có 3 electron.
⇒ Aluminium là kim loại.