Giải Sách bài tập Hóa học 10 Bài 2: Nguyên tố hóa học
Nhận biết
Bài 2.1 trang 6 SBT Hóa học 10: Phát biểu nào sau đây không đúng?
A. Số hiệu nguyên tử bằng số đơn vị điện tích hạt nhân nguyên tử
B. Số khối của hạt nhân bằng tổng số proton và số neutron.
C. Trong nguyên tử, số đơn vị điện tích hạt nhân bằng số proton và bằng số neutron.
D. Nguyên tố hóa học là những nguyên tử có cùng số đơn vị điện tích hạt nhân.
Lời giải:
Đáp án đúng là: C
Phát biểu C là sai. Sửa lại đúng là: Trong nguyên tử, số đơn vị điện tích hạt nhân bằng số proton và bằng số electron.
Bài 2.2 trang 6 SBT Hóa học 10: Số hiệu nguyên tử cho biết thông tin nào sau đây?
A. Số proton
B. Số neutron
C. Số khối
D. Nguyên tử khối
Lời giải:
Đáp án đúng là: A
Số hiệu nguyên tử = số đơn vị điện tích hạt nhân = số proton = số electron.
Bài 2.3 trang 6 SBT Hóa học 10: Dãy nào sau đây gồm các đồng vị của cùng một nguyên tố hóa học?
A.
B.
C.
D.
Lời giải:
Đáp án đúng là: C
Dãy gồm các đồng vị của cùng một nguyên tố hóa học vì cùng có Z = 14.
Bài 2.4 trang 6 SBT Hóa học 10: Kí hiệu nào sau đây viết đúng?
A.
B.
C.
D.
Lời giải:
Đáp án đúng là: A
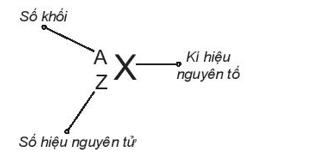
Cách viết kí hiệu nguyên tử:
Bài 2.5 trang 6 SBT Hóa học 10: Thông tin nào sau đây không đúng về
A. Số đơn vị điện tích hạt nhân là 82.
B. Số proton và neutron là 82
C. Số neutron là 124
D. Số khối là 206
Lời giải:
Đáp án đúng là: B
Kí hiệu nguyên tử cho biết:
Số hiệu nguyên tử = số đơn vị điện tích hạt nhân = số proton = số electron = 82
Số khối = 206
Số neutron = số khối – số hiệu nguyên tử = 206 – 82 = 124
Thông hiểu
Bài 2.6 trang 6 SBT Hóa học 10: Cho kí hiệu các nguyên tử sau
Dãy nào sau đây gồm các nguyên tử thuộc cùng một nguyên tố hóa học?
A.
B.
C.
D.
Lời giải:
Đáp án đúng là: D
Các nguyên tử thuộc cùng một nguyên tố hóa học vì cùng có Z = 8.
A. 3
B. 6
C. 9
D. 12
Lời giải:
Đáp án đúng là: D
Đồng vị kết hợp với ( , ); ( , ); (, ); ( ; ); ( , ); ( , ) được 6 hợp chất NO2.
Tương tự, đồng vị kết hợp vớ 6 cặp đồng vị O như trên được 6 hợp chất NO2 nữa.
A. 80,00
B. 80,112
C. 80,986
D. 79,986
Lời giải:
Đáp án đúng là: D
Nguyên tử khối trung bình của bromine là:
= 79,986
A. 16,0
B. 16,2
C. 17,0
D. 18,0
Lời giải:
Đáp án đúng là: A
Nguyên tử khối trung bình của oxygen là:
= 16,0
A. 80
B. 81
C. 82
D. 80,5
Lời giải:
Đáp án đúng là: B
Đặt nguyên tử khối của đồng vị thứ hai là A2
Phần trăm đồng vị A2 là 100% - 54,5% = 45,5%
Ta có:
⇒ A2 = 81
Vậy nguyên tử khối của đồng vị thứ hai là 81.
Vận dụng
Lời giải:
Gọi % là x, % = 100 – x
Ta có:
⇒ x = 19 và 100 – x = 81.
Vậy phần trăm số nguyên tử là 19% và là 81%
Lời giải:
Gọi hàm lượng và lần lượt là x% và y%.
Ta có: 98 + x + y = 100 (1)
(2)
Giải hệ hai phương trình (1) và (2) ta được: x = 1,9 và y = 0,1
Vậy hàm lượng % của đồng vị phóng xạ Co – 60 là 0,1%
Xem thêm lời giải sách bài tập Hóa học 10 Kết nối tri thức với cuộc sống hay, chi tiết khác:
Bài 1: Thành phần của nguyên tử
Bài 3: Cấu trúc lớp vỏ electron nguyên tử
Bài 5: Cấu tạo của bảng tuần hoàn các nguyên tố hóa học
Bài 6: Xu hướng biến đổi một số tính chất của nguyên tử các nguyên tố trong một nhóm