Phản ứng Fe3O4 + HNO3 → Fe(NO3)3 + NO2 + H2O
1. Phương trình phản ứng Fe3O4 tác dụng HNO3 đặc
Fe3O4 + 10HNO3 → 3Fe(NO3)3 + NO2 + 5H2O
2. Điều kiện phản ứng Fe3O4 tác dụng với dung dịch HNO3 đặc
Điều kiện: Không có
3. Cân bằng phản ứng Fe3O4 + HNO3 → Fe(NO3)3 + NO2 + H2O bằng phương pháp thăng bằng electron
Bước 1: Xác định sự thay đổi số oxi hóa
+8/3Fe3O4 + HN+5O3 → Fe+3(NO3)3 + N+4O2 + H2O
Bước 2: Viết quá trình trao đổi electron. Quá trình khử, quá trình oxi hóa
|
1x 1x |
+8/3Fe → 3Fe3+ + 1e N+5 +1e → N+4 |
Bước 3: Đặt hệ số thích hợp
Vậy phương trình phản ứng:
Fe3O4 + 10HNO3 → 3Fe(NO3)3 + NO2 + 5H2O
4. Cách tiến hành phản ứng cho Fe3O4 tác dụng với dung dịch HNO3
Cho Fe3O4 tác dụng với dung dịch axit nitric HNO3 đặc.
5. Hiện tượng phản ứng hóa học
Hiện tượng sau phản ứng thoát ra khí có màu nâu đỏ NO2.
6. Bản chất của các chất tham gia phản ứng
6.1. Bản chất của Fe3O4 (Sắt từ oxit)
- Trong phản ứng trên Fe3O4 là chất khử.
- Oxit sắt từ có tính khử thể hiện khi tác dụng với các chất có tính oxi hoá mạnh như: HNO3, H2SO4 đặc...
6.2. Bản chất của HNO3 (Axit nitric)
- Trong phản ứng trên HNO3 là chất oxi hoá.
- HNO3 tác dụng với oxit bazo, bazo, muối mà kim loại trong hợp chất chưa lên hoá trị cao nhất.
7. Tính chất của Fe3O4
Định nghĩa: Là hỗn hợp của hai oxit FeO, Fe2O3. Có nhiều trong quặng manhetit, có từ tính.
Công thức phân tử Fe3O4
7.1. Tính chất vật lí
Là chất rắn, màu đen, không tan trong nước và có từ tính.
7.2. Tính chất hóa học
- Tính oxit bazơ
Fe3O4 tác dụng với dung dịch axit như HCl, H2SO4 loãng tạo ra hỗn hợp muối sắt (II) và sắt (III).
Fe3O4 + 8HCl → 2FeCl3 + FeCl2 + 4H2O
Fe3O4 + 4H2SO4 loãng→ Fe2(SO4)3 + FeSO4 + 4H2O
- Tính khử
Fe3O4 là chất khử khi tác dụng với các chất có tính oxi hóa mạnh:
3Fe3O4 + 28HNO3 → 9Fe(NO3)3 + NO + 14H2O
2Fe3O4 + 10H2SO4 → 3Fe2(SO4)3 + SO2↑ + 10H2O
- Tính oxi hóa
Fe3O4 là chất oxi hóa khi tác dụng với các chất khử mạnh ở nhiệt độ cao như: H2, CO, Al:
Fe3O4 + 4H2 → 3Fe + 4H2O
Fe3O4 + 4CO → 3Fe + 4CO2
3Fe3O4 + 8Al → 4Al2O3 + 9Fe
8. Bài tập vận dụng liên quan
Câu 1. Chất nào sau đây khí phản ứng với dung dịch HNO3 đặc nóng sẽ không sinh ra khí?
A. FeO
B. Fe3O4
C. Fe2O3
D. Fe(OH)2
Lời giải:
Câu 2. Hòa tan một lượng FexOy bằng H2SO4 loãng dư được dung dịch X. Biết X vừa có khả năng làm mất màu dung dịch thuốc tím, vừa có khả năng hòa tan được bột Cu. Oxit sắt đó là:
A. FeO
B. Fe2O3
C. Fe3O4
D. A hoặc B
Lời giải:
Dung dịch X vừa làm mất màu dung dịch thuốc tím, vừa có khả năng hòa tan được bột Cu → trong dung dịch X có Fe2+
→ Oxit sắt là Fe3O4
Câu 3. Hoà tan hoàn toàn m (g) FexOy bằng dung dịch H2SO4 đặc nóng thu được 2,24lit SO2 (đktc). Phần dd chứa 120(g) một loại muối sắt duy nhất. Công thức oxit sắt và khối lượng m là:
A. Fe3O4; m = 23,2 (g).
B. FeO, m = 32 (g).
C. FeO; m = 7,2 (g).
D. Fe3O4; m = 46,4 (g)
Lời giải:
xFe2y/x + → xFe3+ + (3x – 2y)e
S6+ + 2e (0,2) → S4+ (0,1 mol)
nmuối = nFe2(SO4)3 = 0,3 mol ⇒ nFe2y/x + = 0,6 mol
Bảo toàn e: 0,6.(3x-2y)2 = 0,2 ⇒ x : y = 3 : 4 ⇒ nFe3O4 = 0,2 ⇒ m = 0,2. 232 = 46,4g
Câu 4. Hòa tan hoàn toàn 2,8 gam hỗn hợp FeO, Fe2O3 và Fe3O4 cần vừa đủ V ml dung dịch HCl 1M , thu được dung dịch X. Cho từ từ dung dịch NaOH dư vào dung dịch X thu được kết tủa Y. Nung Y trong không khí đến khối lượng không đổi thu được 3 gam chất rắn. Tính V ?
A. 87,5ml
B. 125ml
C. 62,5ml
D. 175ml
Lời giải:
Coi hỗn hợp ban đầu gồm Fe, O.
nFe = 2nFe2O3 = 0,0375 mol
⇒ nO = 28-0,0375.5616 = 0,04375 mol
Bảo toàn nguyên tố O → nH2O = nO = 0,04375
Bảo toàn nguyên tố H: nHCl = 2nH2O = 0,0875 mol → V = 87,5 ml.
Câu 5. Trong các phản ứng sau, phản ứng nào HNO3 không đóng vai trò chất oxi hóa?
A. ZnS + HNO3(đặc nóng)
B. Fe2O3 + HNO3(đặc nóng)
C. FeSO4 + HNO3(loãng)
D. Cu + HNO3(đặc nóng)
Lời giải:
Câu 6. Hòa tan hỗn hợp ba kim loại gồm Zn, Fe, Cu bằng dung dịch HNO3 loãng. Sau khi phản ứng xảy ra hoàn toàn, thu được chất không tan là hỗn hợp hai kim loại. Phần dung dịch sau phản ứng có chứa
A. Zn(NO3)2 và Fe(NO3)3.
B. Zn(NO3)2; Fe(NO3)2 và Cu(NO3)2.
C. Zn(NO3)2 và Fe(NO3)2.
D. Zn(NO3)2; Fe(NO3)3 và Cu(NO3)2.
Sau phản ứng còn Cu dư, chứng tỏ HNO3 phản ứng hết.
3Zn + 8HNO3 → 3Zn(NO3)2 + 2NO + 4H2O
Fe + 4HNO3→ Fe(NO3)3 + NO + 2H2O
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
Cu + 2Fe(NO3)3 → Cu(NO3)2 + 2Fe(NO3)2
=> Dung dịch sau phản ứng chứa: Zn(NO3)2; Fe(NO3)2; Cu(NO3)2.
Câu 7. Cho từng chất: Fe, FeO, Fe(OH)2, Fe(OH)3, Fe3O4, Fe2O3, Fe(NO3)2, Fe(NO3)3, FeSO4, Fe2(SO4)3, FeCO3 lần lượt phản ứng với HNO3 đặc nóng thì số phàn ứng ô xi hóa khử xảy ra là
A. 5
B. 6
C. 7
D. 8
Lời giải:
Câu 8. Cho m gam Fe tác dụng hoàn toàn với dung dịch H2SO4 đặc, nóng (dư) thu được 13,44 lít khí SO2 sản phầm khử duy nhất (ở đktc). Tính giá trị của m?
A. 11,2 gam
B. 22,4 gam
C. 16,8 gam
D. 33, 6 gam
Lời giải:
nSO2 = 13,4422,4= 0,6
Phương trình hóa học
2Fe + 6H2SO4 đặc nóng → Fe2(SO4)3 + 3SO2 + 6H2O
Ta có: nFe = 23.nSO2 = 23. 0,6 = 0,4 mol
Khối lượng sắt là:
→ mFe = 0,4.56 = 22,4 gam
Câu 9. Hòa tan hoàn toàn 20 gam hỗn hợp Mg và Fe trong dung dịch HCl 4M thu được 11,2 lít H2 (đktc) và dung dịch X. Để kết tủa hoàn toàn các ion trong X cần 600 ml dung dịch KOH 2M. Thể tích dung dịch HCl đã dùng là :
A. 0,1 lít.
B. 0,3 lít.
C. 0,15 lít.
D. 0,2 lít.
Lời giải:
Áp dụng định luật bảo toàn nguyên tố Natri
nKCl = nKOH = 1,2 (mol)
Áp dụng định luật bảo toàn nguyên tố Clo
=> nHCl= nKCl = 1,2 (mol)
VHCl= 1,24 = 0,3 lít
Câu 10. Cho m gam Fe tác dụng hết với dung dịch CuSO4 dư, thu được 14,4 gam Cu. Giá trị của m là
A. 50,4.
B. 12,6.
C. 16,8.
D. 25,2.
Lời giải:
nCu = 0,225 mol
Phương trình hóa học phản ứng xảy ra:
CuSO4 + Fe → FeSO4+ Cu
0,225 ← 0,225 mol
⟹ mFe = 0,225.56 = 12,6 gam
Câu 11. Sắt tác dụng được với tất cả các chất thuộc dãy chất nào sau đây?
A. HNO3 đặc nguội, Cl2, dung dịch CuSO4.
B. O2, dung dịch HCl, dung dịch Cu(NO3)2, dung dịch NaOH.
C. Al2O3, H2O, HNO3 loãng, dung dịch AgNO3.
D. S, dung dịch Fe(NO3)3, dung dịch H2SO4 loãng
Lời giải:
S, dung dịch Fe(NO3)3, dung dịch H2SO4 loãng.
HNO3 đặc nguội, dung dịch NaOH, Al2O3 không phản ứng với Fe.
Fe + S → FeS
Fe + 2Fe(NO3)3 → 3Fe(NO3)2
Fe + H2SO4 loãng→ FeSO4+ H2↑.
Câu 12. Khi cho Fe vào dung dịch hỗn hợp các muối AgNO3, Cu(NO3)2, Pb(NO3)2 thì Fe sẽ khử ion kim loại theo thứ tự sau (ion đặt trước sẽ bị khử trước):
A. Ag+, Cu2+, Pb2+.
B. Ag+, Pb2+, Cu2+.
C. Cu2+, Ag+, Pb2+.
D .Pb2+, Ag+, Cu2+
Lời giải:
Câu 13. Cho các phản ứng xảy ra sau đây:
(1) AgNO3 + Fe(NO3)2 → Fe(NO3)3 + Ag↓
(2) Mn + 2HCl → MnCl2 + H2↑
Dãy các ion được sắp xếp theo chiều tăng dần tính oxi hoá là
A. Ag+, Mn2+, H+, Fe3+.
B. Mn2+, H+, Ag+, Fe3+.
C. Ag+, Fe3+, H+, Mn2+
D. Mn2+, H+, Fe3+, Ag+
Lời giải:
Dựa vào phản ứng xác định ion nào có tính oxi hóa mạnh hơn rồi sắp xếp
KL mạnh + chất oxi hóa mạnh => KL yếu + chất oxi hóa yếu
(1) AgNO3 + Fe(NO3)2 → Fe(NO3)3 + Ag↓
→ tính oxi hóa của Fe3+ < Ag+
(2) Mn + 2HCl → MnCl2 + H2↑
→ tính oxi hóa của Mn2+ < H+
Câu 14. Một pin điện hoá có điện cực Zn nhúng trong dung dịch ZnSO4 và điện cực Cu nhúng trong dung dịch CuSO4. Ta thấy
A. điện cực Cu xảy ra quá trình khử.
B. điện cực Zn tăng còn khối lượng điện cực Cu giảm.
C. điện cực Cu xảy ra sự oxi hoá.
D. điện cực Zn xảy ra sự khử
Lời giải:
Trong pin điện hóa Zn-Cu xảy ra quá trình :
Zn → Zn2+ + 2e (sự oxi hóa, làm thanh Zn bị mòn đi)
Cu2+ + 2e → Cu (sự khử, làm thanh Cu dày lên)
Câu 15. Hòa tan một lượng FexOy bằng H2SO4 loãng dư được dung dịch X. Biết X vừa có khả năng làm mất màu dung dịch thuốc tím, vừa có khả năng hòa tan được bột Cu. Oxit sắt đó là:
A. FeO
B. Fe2O3
C. Fe3O4
D. A hoặc B
Lời giải:
Đáp án: C
Giải thích:
Dung dịch X vừa làm mất màu dung dịch thuốc tím, vừa có khả năng hòa tan được bột Cu
→ Trong dung dịch X có Fe2+ và Fe3+.
→ Oxit sắt là Fe3O4.
Phương trình phản ứng:
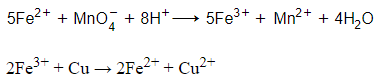
Câu 16. Hòa tan hoàn toàn 2,8 gam hỗn hợp FeO, Fe2O3 và Fe3O4 cần vừa đủ V ml dung dịch HCl 1M, thu được dung dịch X. Cho từ từ dung dịch NaOH dư vào dung dịch X thu được kết tủa Y. Nung Y trong không khí đến khối lượng không đổi thu được 3 gam chất rắn. Tính V?
A. 87,5 ml
B. 125 ml
C. 62,5 ml
D. 175 ml
Lời giải:
Đáp án: A
Giải thích:
FeO, Fe2O3, Fe3O4 +HCl→ FeCl2, FeCl3 →+NaOH,t° Fe2O3
= 3 : 160 = 0,01875 gam
Coi hỗn hợp ban đầu gồm Fe, O.
nFe = 2 = 2.0,01875
= 0,0375 mol
→ nO =
= 0,04375 mol
Bảo toàn nguyên tố O
→ = nO = 0,04375 mol
Bảo toàn nguyên tố H:
nHCl = 2 = 2.0,04375
= 0,0875 mol
→ V = 87,5 ml.
Xem thêm các phương trình hóa học liên quan khác:
Fe3O4 + HNO3 → Fe(NO3)3 + NO + H2O | Fe3O4 ra Fe(NO3)3
Fe3O4 + H2SO4 → Fe2(SO4)3 + SO2 + H2O | Fe3O4 ra Fe2(SO4)3
Fe3O4 + H2SO4 → FeSO4 + Fe2(SO4)3 + H2O | Fe3O4 ra Fe2(SO4)3




