Đề cương Giữa học kì 2 Hóa học 10 Kết nối tri thức
I. Kiến thức ôn tập
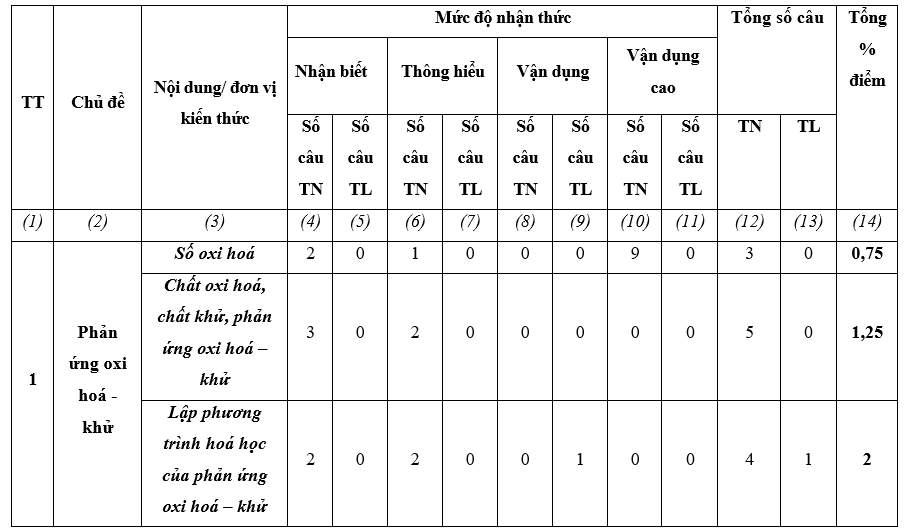
Chương 4: Phản ứng oxi hóa khử
1. Khái niệm và quy tắc xác định của số oxi hóa.
2. Khái niệm phản ứng oxi hóa - khử, chất khử, chất oxi hóa, quá trình khử ,quá trình oxi hóa.
3. Lập phương trình hóa học của phản ứng oxi hóa - khử bằng phương pháp thăng bằng e.
4. Một số phản ứng oxi hóa – khử quan trọng trong cuộc sống.
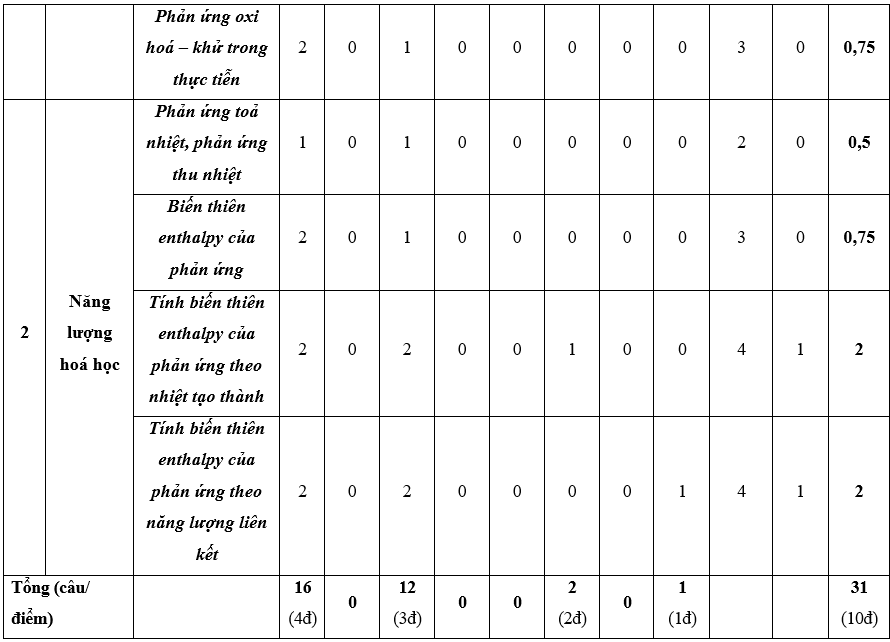
Chương 5: Năng lượng hóa học
1. Khái niệm phản ứng tỏa nhiệt, thu nhiệt, điều kiện chuẩn, nhiệt tạo thành và biến thiên enthalpy của phản ứng.
2. Ý nghĩa của biến thiên enthalpy chuẩn.
3. Tính biến thiên enthalpy chuẩn của một số phản ứng theo năng lượng liên kết, nhiệt tạo thành.
II. Ma trận đề thi
Ma trận đề kiểm tra giữa kì II – Hóa học 10 – bộ sách KNTT
Lưu ý:
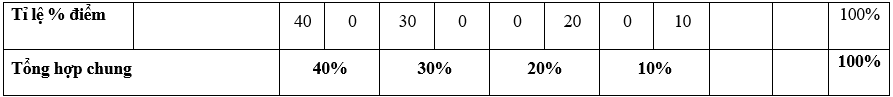
- Hình thức kiểm tra: Kết hợp giữa trắc nghiệm và tự luận (tỉ lệ 70% trắc nghiệm, 30% tự luận).
- Cấu trúc:
+ Mức độ đề: 40% Nhận biết; 30% Thông hiểu; 20% Vận dụng; 10% Vận dụng cao.
+ Phần trắc nghiệm: 28 câu, 7,0 điểm (gồm 16 câu ở mức độ nhận biết;12 câu ở mức độ thông hiểu), mỗi câu 0,25 điểm;
+ Phần tự luận: 3,0 điểm (Vận dụng: 02 câu, 2,0 điểm; Vận dụng cao: 1-2 câu, 1,0 điểm).
- Các câu hỏi ở mức độ nhận biết và thông hiểu là các câu hỏi trắc nghiệm khách quan 4 lựa chọn, trong đó có duy nhất 1 lựa chọn đúng; các câu hỏi ở mức độ vận dụng và vận dụng cao là các câu hỏi tự luận.
- Với các câu hỏi TNKQ ở mức độ nhận biết và mức độ thông hiểu, mỗi câu hỏi kiểm tra, đánh giá 01 yêu cầu cần đạt của chương trình.
- Không chọn câu ở mức độ vận dụng và câu ở mức độ vận dụng cao trong cùng một đơn vị kiến thức.
III. Câu hỏi ôn tập
1. Câu hỏi trắc nghiệm
Câu 1: Trong hợp chất SO3, số oxi hóa của sulfur (lưu huỳnh) là
A. +2 B. +3.
C. +4. D. +6.
Câu 2: Số oxi hóa của chromium (Cr) trong Na2CrO4 là
A. +3. B. +2.
C. +6. D. +7.
Câu 3: Phản ứng oxi hóa – khử là
A. phản ứng hoá học xảy ra đồng thời quá trình nhường electron và quá trình nhận electron.
B. phản ứng hóa học trong đó hai hay nhiều chất ban đầu sinh ra một chất mới.
C. phản ứng hóa học giữa đơn chất và hợp chất, trong đó nguyên tử của đơn chất thay thế nguyên tử của một nguyên tố khác trong hợp chất.
D. phản ứng hóa học trong đó một chất sinh ra hai hay nhiều chất mới.
Câu 4: Phát biểu nào sau đây không đúng ?
A. Số oxi hóa là điện tích quy ước của nguyên tử trong phân tử khi coi tất cả các electron liên kết đều chuyển hoàn toàn về nguyên tử có độ âm điện lớn hơn.
B. Trong hợp chất, oxygen có số oxi hóa bằng -2, trừ một số trường hợp ngoại lệ.
C. Số oxi hóa của hydrogen trong các hydride kim loại bằng +1.
D. Các nguyên tố phi kim có số oxi hóa thay đổi tùy thuộc vào hợp chất chứa chúng.
Câu 5: Trong phản ứng oxi hoá – khử, chất nhường electron được gọi là
A. chất khử. B. chất oxi hoá.
C. acid. D. base.
Câu 6: Cho quá trình Al → Al3+ + 3e, đây là quá trình
A. khử.
B. oxi hóa.
C. tự oxi hóa – khử.
D. nhận proton.
Câu 7: Dẫn khí H2 đi qua ống sứ đựng bột CuO nung nóng để thực hiện phản ứng hóa học sau: CuO + H2 to→ Cu + H2O. Trong phản ứng trên, chất đóng vai trò chất oxi hoá là
A. CuO. B. H2.
C. Cu. D. H2O.
Câu 8: Trong phản ứng MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O, vai trò của HCl là
A. chất oxi hóa.
B. chất khử.
C. tạo môi trường.
D. chất khử và môi trường.
Câu 9: Phản ứng nào dưới đây thuộc loại phản ứng oxi hóa - khử?
A. AgNO3 + NaCl → AgCl + NaNO3.
B. NaOH + HCl → NaCl + H2O.
C. FeO + 4HNO3 → Fe(NO3)3 + NO2 + 2H2O.
D. CaO + CO2 → CaCO3.
Câu 10: Cho phương trình hóa học: aFe + bH2SO4 → cFe2(SO4)3 + dSO2 ↑ + eH2O
Tỉ lệ a : b là
A. 1 : 3. B. 1 : 2.
C. 2 : 3. D. 2 : 9.
Câu 11: Để hàn nhanh đường ray tàu hỏa bị hỏng, người ta dùng hỗn hợp tecmit để thực hiện phản ứng nhiệt nhôm: Al + Fe2O3 → Al2O3 + Fe. Phát biểu nào sau đây sai?
A. Al là chất khử.
B. Fe2O3 là chất oxi hóa.
C. Tỉ lệ giữa chất bị khử : chất bị oxi hóa là 2 :1.
D. Sản phẩm khử là Fe.
Câu 12: Cho sơ đồ chuyển hóa nitrogen như sau:
N2+O2→(1)NO+O2→(2)NO2+O2+H2O→(3)HNO3+CuO→(4)Cu(NO3)2to→(5)NO2
Có bao nhiêu phản ứng oxi hóa - khử ở sơ đồ trên?
A. 5. B. 4.
C. 3. D. 2.
Câu 13: Cho 2,34 g kim loại M (hóa trị n) tác dụng với dung dịch H2SO4 (đặc, nóng, dư) thu được 3,2227 L SO2 (điều kiện chuẩn). Kim loại M là
A. Al. B. Fe.
C. Cu. D. Mg.
Câu 14: Rượu gạo là một thức uống có cồn lên men được chưng cất từ gạo theo truyền thống. Rượu gạo được làm từ quá trình lên men tinh bột đã được chuyển thành đường. Vi khuẩn là nguồn gốc của các enzyme chuyển đổi tinh bột thành đường. Nhiệt độ phù hợp để lên men rượu khoảng 20 – 25oC. Phản ứng thủy phân và lên men:
(1) (C6H10O5)n + nH2O → nC6H12O6
(2) C6H12O6 → 2C2H5OH + 2CO2
Phản ứng là phản ứng oxi hóa – khử là
A. Phản ứng (1).
B. Phản ứng (2).
C. Cả hai phản ứng (1) và (2).
D. Không có phản ứng nào thoả mãn.
Câu 15: Trong quá trình Ostwald dùng để sản xuất nitric acid từ ammonia, được đề xuất vào năm 1902. Ở giai đoạn đầu của quá trình xảy ra phản ứng sau:
4NH3 + 5O2 to→ 4NO + 6H2O
Chất khử là
A. NH3. B. O2.
C. NO. D. H2O.
Câu 16: Trong không khí ẩm, các vật dụng bằng thép bị oxi hoá tạo ra gỉ sắt:
4Fe + 3O2 + xH2O → 2Fe2O3.xH2O
Phản ứng trên thuộc loại
A. Phản ứng oxi hoá – khử.
B. Phản ứng trao đổi.
C. Phản ứng thế.
D. Phản ứng nhiệt phân.
Câu 17: Phản ứng nào sau đây là phản ứng tỏa nhiệt?
A. Phản ứng phân huỷ đá vôi.
B. Phản ứng nhiệt phân thuốc tím.
C. Phản ứng oxi hóa glucose trong cơ thể.
D. Phản ứng hòa tan NH4Cl trong nước.
Câu 18: Phát biểu nào sau đây là không đúng?
A. Biến thiên enthalpy càng âm, phản ứng tỏa ra càng nhiều nhiệt.
B. Biến thiên enthalpy càng dương, phản ứng thu vào càng nhiều nhiệt.
C. Sự đốt cháy các loại nhiên liệu như xăng, dầu … xảy ra nhanh và toả nhiều nhiệt.
D. Các phản ứng xảy ra ở nhiệt độ phòng thường là phản ứng thu nhiệt.
Câu 19: Phương trình nhiệt hóa học là
A. phương trình phản ứng hóa học xảy ra trong điều kiện cung cấp nhiệt độ.
B. phương trình phản ứng hóa học có kèm theo nhiệt phản ứng.
C. phương trình phản ứng hóa học có kèm theo nhiệt phản ứng và trạng thái của các chất đầu và sản phẩm.
D. phương trình phản ứng hóa học tỏa nhiệt ra môi trường.
Câu 20: Cho phương trình nhiệt hóa học của phản ứng:
2H2(g) + O2(g) → 2H2O(l) ΔrHo298= –
Phản ứng trên là phản ứng
A. không có sự thay đổi năng lượng.
B. có sự hấp thụ nhiệt lượng từ môi trường xung quanh.
C. thu nhiệt.
D. tỏa nhiệt.
Câu 21: Cho các phản ứng sau:
(1) C(s) + O2(g) CO2(g)
(2) 2Al(s) + O2(g) Al2O3(s)
(3) CH4(g) + 2O2(g) CO2(g) + 2H2O(l)
(4) C2H2(g) + O2(g) 2CO2(g) + H2O (l)
Trong các phản ứng trên, phản ứng nào tỏa nhiều nhiệt nhất?
A. (1). B. (2).
C. (3). D. (4).
Câu 22: Khi nung vôi, người ta phải xếp đá vôi lẫn với than trong lò vì
A. phản ứng nung vôi là phản ứng tỏa nhiệt.
B. phản ứng nung vôi là phản ứng thu nhiệt, cần nhiệt từ quá trình đốt cháy than.
C. thời gian nung vôi dài.
D. than hấp thu bớt lượng nhiệt tỏa ra của phản ứng nung vôi.
Câu 23. Điều kiện chuẩn là điều kiện ứng với
A. áp suất 1 bar (đối với chất khí), nồng độ 1 mol/L (đối với chất tan trong dung dịch) và nhiệt độ thường được chọn là 298K (25oC).
B. áp suất 1 atm (đối với chất khí), nồng độ 1 mol/L (đối với chất tan trong dung dịch) và nhiệt độ thường được chọn là 298K (25oC).
C. áp suất 1 bar (đối với chất khí), nồng độ 2 mol/L (đối với chất tan trong dung dịch) và nhiệt độ thường được chọn là 298K (25oC).
D. áp suất 2 atm (đối với chất khí), nồng độ 2 mol/L (đối với chất tan trong dung dịch) và nhiệt độ thường được chọn là 298K (25oC).
Câu 24: Cho phản ứng tổng quát: aA + bB → mM + nN. Cho các phương án tính của phản ứng:
(a) = m.(M) + n.(n) – a. (A) – b. (B).
(b) = a. (A) + b. (B) – m.(M) – n. (N).
(c) = a. Eb(A) + b.Eb(B) – m.Eb(M) – n.Eb(N)
(d) = m.Eb(M) + n.Eb(N) – a. Eb(A) – b.Eb(B)
Số phương án tính của phản ứng đúng là
A. 1. B. 2.
C. 3. D. 4.
Câu 25: Enthalpy tạo thành chuẩn của các đơn chất bền bằng
A. +1 kJ/ mol.
B. -1 kJ/ mol.
C. +2 kJ/ mol.
D. 0 kJ/ mol.
Câu 26: Cho các phát biểu sau:
(a) Biến thiên enthalpy chuẩn của một phản ứng hóa học là lượng nhiệt kèm theo phản ứng đó ở áp suất 1 atm và 25 oC.
(b) Nhiệt (tỏa ra hay thu vào) kèm theo một phản ứng được thực hiện ở 1 bar và 298 K là biến thiên enthalpy chuẩn của phản ứng đó.
(c) Một số phản ứng khi xảy ra làm môi trường xung quanh lạnh đi là do các phản ứng này thu nhiệt và lấy nhiệt từ môi trường.
(d) Một số phản ứng khi xảy ra làm môi trường xung quanh nóng lên là phản ứng thu nhiệt.
Số phát biểu không đúng là
A. 2. B. 3.
C. 4. D. 1.
Câu 27: Cho giá trị trung bình của các năng lượng liên kết ở điều kiện chuẩn:
|
Liên kết |
C–H |
C–C |
C=C |
|
Eb (kJ/mol) |
418 |
346 |
612 |
Biến thiên enthalpy của phản ứng: C3H8(g) → CH4(g) + C2H4(g) có giá trị là
A. +103 kJ. B. –103 kJ.
C. +80 kJ. D. –80 kJ.
Câu 28: Cho biến thiên enthalpy của phản ứng sau ở điều kiện chuẩn:
CO(g) + ##O2(g) → CO2(g)
Biết nhiệt tạo thành chuẩn của CO2: ##(CO2(g)) = –393,5 kJ/mol. Nhiệt tạo thành chuẩn của CO là
A. –110,5 kJ. B. +110,5 kJ.
C. –141,5 kJ. D. –221,0 kJ.
Câu 29. Số oxi hóa của S trong SO2 và lần lượt là
A. +2, +4.
B. -2, -4.
C. +4, +6.
D. -4, +6.
Câu 30. Cho các chất sau: Cl2; HCl; NaCl; KClO3; HClO4; số oxi hóa của nguyên tử Cl trong phân tử các chất trên lần lượt là
A. 0; +1; +1; +5; +7.
B. 0; -1; -1; +5; +7.
C. 1; -1; -1; -5; -7.
D. 0; 1; 1; 5; 7.
Câu 31. Dấu hiệu để nhận biết một phản ứng oxi hóa – khử là dựa trên sự thay đổi đại lượng nào sau đây của nguyên tử?
A. Số khối.
B. Số oxi hóa.
C. Số hiệu
D. Số mol.
Câu 32. Chất khử là chất
A. Nhường e, chứa nguyên tố có số oxi hóa tăng sau phản ứng.
B. Nhường e, chứa nguyên tố có số oxi hóa giảm sau phản ứng.
C. Nhận e, chứa nguyên tố có số oxi hóa tăng sau phản ứng.
D. Nhận e, chứa nguyên tố có số oxi hóa giảm sau phản ứng.
Câu 33. Quá trình oxi hoá là
A. Quá trình nhường electron.
B. Quá trình nhận electron.
C. Quá trình tăng electron.
D. Quá trình giảm số oxi hoá.
2. Câu hỏi tự luận
Câu 1: Cân bằng các phản ứng sau bằng phương pháp thăng bằng electron, nêu rõ chất oxi hóa, chất khử, quá trình oxi hoá, quá trình khử:
a) H2S + SO2 → S + H2O
b) KMnO4 + HCl → KCl + MnCl2 + Cl2 + H2O
Câu 2: Ở điều kiện chuẩn, 1 mol nhôm tác dụng vừa đủ với khí chlorine tạo ra muối aluminium chloride và giải phóng một lượng nhiệt 695,405 kJ.
a) Viết phương trình hoá học của phản ứng và cho biết phản ứng này có là phản ứng oxi hóa – khử không? Vì sao?
b) Biến thiên enthalpy chuẩn của phản ứng bằng bao nhiêu? Phản ứng thu nhiệt hay tỏa nhiệt?
Câu 3: Phản ứng tạo thành propene từ propyne:
##
a) Hãy xác định số liên kết C – H; C – C; C ≡ C trong hợp chất CH3 – C ≡ CH (propyne).
b) Cho năng lượng của các liên kết:
|
Liên kết |
C – H |
C – C |
C = C |
C ≡ C |
H - H |
|
Eb (kJ/mol) |
413 |
347 |
614 |
839 |
432 |
Hãy tính biến thiên enthalpy của phản ứng tạo thành propene trên.
Câu 4. Hoàn thành các phương trình hóa học sau theo phương pháp thăng bằng electron. Chỉ rõ chất khử, chất oxi hóa.
Câu 5. Hoàn thành các phương trình hóa học sau theo phương pháp thăng bằng electron. Chỉ rõ chất khử, chất oxi hóa.
a. NH3 + CuO → Cu + N2 + H2O.
b. P + H2SO4đ → H3PO4 + SO2 + H2O
c. KMnO4 + HClđ → KCl + MnCl2 + Cl2 + H2O
d. Al + HNO3 → Al(NO3)3 + N2O + H2O.
e. Cl2 + NaOH → NaCl + NaClO3 + H2O
Câu 6. Các quá trình sau thu nhiệt hay tỏa nhiệt? Giải thích ngắn gọn?
a. Quá trình pháo hoa cháy sáng trong không khí.
b. Quá trình quang hợp của thực vật vào ban ngày.
c. Quá trình oxi hóa carbohydrate trong cơ thể con người.
d. Nhiệt phân magnesium nitrate.
e. Hòa tan muối NH4Cl vào nước thấy cốc nước trở nên mát.
f. Giọt nước đọng lại trên lá cây vào ban đêm.
Câu 7. Một số loại xe ôtô được trang bị một thiết bị an toàn là túi chứa môt lượng nhất định hợp chất ion sodium azide (NaN3), được gọi là túi khí. Khi có va cham xảy ra mạnh sodium azide bị phân hủy rất nhanh, giải phóng khí N2 và nguyên tố Na, làm túi phồng lên, bảo vệ được người trong xe tránh khỏi thương tích. Viết phương trình hóa học của phản ứng xảy ra và xác định đây có phải phản ứng oxi hóa - khử không? Vì sao? Xác định số oxi hóa của mỗi nguyên tử trong NaN3.
Câu 8. Hàm lượng iron (II) sulfate được xác định qua phản ứng oxi hóa – khử với potassium permanganate:
FeSO4 + KMnO4 + H2SO4 -- Fe2 (SO4 )3 + K2SO4 + MnSO4 + H2O
a. Hoàn thành phương trình phản ứng theo phương pháp thăng bằng electron. Chỉ rõ chất khử, chất oxi hóa.
b. Tính thể tích dung dịch KMnO4 0,02M để phản ứng vừa đủ 20 mL dung dịch FeSO4 0,1M.
Câu 9. Cho 2,34 g kim loại M (hóa trị n) tác dụng với dung dịch H2SO4 (đặc nóng, dư) thu được muối sulfate của M, 3,2227 lít SO2 (đk chuẩn), và nước. Xác định kim loại M.
Câu 10: Viết phương trình nhiệt hóa học của các quá trình tạo thành những chất sau từ đơn chất.
a. Nước ở trạng thái khí biết rằng khi tạo thành 1 mol hơi nước từ các đơn chất ở trạng thái bền vững nhất trong điều kiện thường giải phóng 214,6 kJ nhiệt.
b. Ammonia (NH3) ở trạng thái khí biết để tạo thành 2,5 gam ammonia từ các đơn chất ở trạng thái bền vững nhất trong điều kiện thường giải phóng 22,99 kJ nhiệt.
IV. Đề thi minh họa
Đề số 1
Phần I: Trắc nghiệm (7 điểm)
Câu 1: Quy tắc xác định số oxi hoá nào sau đây không đúng?
A. Trong đơn chất, số oxi hoá của nguyên tử bằng 0.
B. Trong phân tử hợp chất, số oxi hoá của oxygen luôn là -2.
C. Trong hợp chất, tổng số oxi hoá của các nguyên tử trong phân tử bằng 0.
D. Trong ion đơn nguyên tử, số oxi hoá của nguyên tử bằng điện tích ion.
Câu 2: Số oxi hóa của aluminium trong Al, Al2O3 lần lượt là
A. 0, +2. B. 0, +3.
C. +3, 0. D. 0, -3.
Câu 3: Số oxi hóa của chromium trong K2Cr2O7 là
A. +1. B. +4.
C. +6. D. +7.
Câu 4: Dấu hiệu để nhận biết một phản ứng oxi hóa – khử là dựa trên sự thay đổi đại lượng nào sau đây của nguyên tử?
A. Khối lượng nguyên tử.
B. Số oxi hóa.
C. Số hiệu nguyên tử.
D. Số khối.
Câu 5: Cho phản ứng: NH3 + HCl → NH4Cl. Trong đó, NH3 đóng vai trò là
A. chất khử.
B. vừa là chất oxi hoá vừa là chất khử.
C. chất oxi hoá.
D. không phải là chất khử, không là chất oxi hoá.
Câu 6: Trong phản ứng nào sau đây HCl đóng vai trò là chất oxi hoá?
A. 2HCl + FeO → FeCl2 + H2O.
B. 2HCl + Na2CO3 → 2NaCl + CO2 + H2O.
C. 16HCl + 2KMnO4 → 2KCl + 2MnCl2 + 5Cl2 + 8H2O.
D. 2HCl + Mg → MgCl2 + H2.
Câu 7: Chất khử là chất
A. nhường electron, chứa nguyên tố có số oxi hóa tăng sau phản ứng.
B. nhường electron, chứa nguyên tố có số oxi hóa giảm sau phản ứng.
C. nhận electron, chứa nguyên tố có số oxi hóa tăng sau phản ứng.
D. nhận electron, chứa nguyên tố có số oxi hóa giảm sau phản ứng.
Câu 8: Trong phản ứng hoá học: 2Al + 6HCl → 2AlCl3 + H2, mỗi nguyên tử Al đã
A. nhận 3 electron.
B. nhường 3 electron.
C. nhận 2 electron.
D. nhường 2 electron.
Câu 9: Cho phản ứng: Mg + H2SO4 → MgSO4 + H2S + H2O. Khi hệ số cân bằng phản ứng là nguyên và tối giản thì số phân tử H2O tạo thành là
A. 3. B. 10.
C. 5. D. 4.
Câu 10: Cho từng chất: Fe, FeO, Fe(OH)2, Fe(OH)3, FeSO4, Fe2O3, Fe(NO3)2 lần lượt phản ứng với HNO3 đặc, nóng. Số phản ứng thuộc loại phản ứng oxi hoá - khử là
A. 4. B. 5.
C. 7. D. 6.
Câu 11: Tổng hệ số cân bằng (là các số nguyên, tối giản) của các chất trong phản ứng dưới đây là
Fe3O4 + HNO3 Fe(NO3)3 + NO + H2O
A. 55. B. 20.
C. 25. D. 50.
Câu 12: Cho 17,4 gram MnO2 tác dụng với dung dịch HCl đặc, dư theo sơ đồ phản ứng sau: MnO2 + HCl → MnCl2 + Cl2↑ + H2O. Số mol HCl bị oxi hoá là
A. 0,2. B. 0,1.
C. 0,4. D. 0,8.
Câu 13: Một số loại xe ô tô được trang bị một thiết bị an toàn là túi chứa một lượng nhất định hợp chất ion sodium azide (NaN3), được gọi là "túi khí". Khi có va chạm mạnh xảy ra, sodium azide bị phân huỷ rất nhanh, giải phóng khí N2 và nguyên tố Na, làm túi phồng lên, bảo vệ được người trong xe tránh khỏi thương tích. Phương trình hoá học của phản ứng phân huỷ sodium azide là
A. 2NaN3 → 2Na + 3N2.
B. 2NaN3 → 2Na + N2.
C. NaN3 → Na + 3N2.
D. 2NaN3 → Na + 3N2
Câu 14: Trong công nghiệp, sulfuric acid được sản xuất từ quặng pirite sắt có thành phần chính là FeS2, theo sơ đồ sau: FeS2 → SO2 → SO3 → H2SO4.
Khối lượng H2SO4 98% điều chế được từ 1 tấn quặng chứa 60% FeS2 (biết hiệu suất cả quá trình là 80%) là
A. 0,4 tấn. B. 0,6 tấn.
C. 0,8 tấn. D. 1,0 tấn.
Câu 15: Sản xuất gang trong công nghiệp bằng cách sử dụng khí CO khử Fe2O3 ở nhiệt độ cao theo phản ứng sau:
Trong phản ứng trên chất đóng vai trò chất khử là
A. Fe2O3. B. CO.
C. Fe. D. CO2.
Câu 16: Phản ứng thu nhiệt là
A. phản ứng hấp thụ năng lượng dưới dạng nhiệt.
B. phản ứng giải phóng năng lượng dưới dạng nhiệt.
C. phản ứng cung cấp nhiệt cho môi trường.
D. phản ứng làm nhiệt độ môi trường tăng lên.
Câu 17: Trong các phản ứng sau:
(1) Phản ứng đốt cháy cồn.
(2) Phản ứng tôi vôi.
(3) Phản ứng nhiệt phân thuốc tím.
Phản ứng toả nhiệt là
A. (1). B. (1) và (2).
C. (2) và (3). D. (1), (2) và (3).
Câu 18: Phản ứng thu nhiệt thì
A. ∆rH = 0. B. ∆rH < 0.
C. ∆rH > 0. D. ∆rH ≥ 0.
Câu 19: Biến thiên enthalpy chuẩn của phản ứng là
A. nhiệt lượng toả ra của phản ứng ở điều kiện áp suất không đổi.
B. nhiệt lượng thu vào của phản ứng ở điều kiện áp suất không đổi.
C. nhiệt lượng toả ra hoặc thu vào của phản ứng ở điều kiện áp suất không đổi.
D. nhiệt lượng toả ra hoặc thu vào của phản ứng ở điều kiện chuẩn.
Câu 20: Cho các phản ứng sau:
(1) C2H5OH(l) + 3O2(g) → 2CO2(g) + 3H2O(l)
(2) .
(3) 2H2(g) + O2(g) → 2H2O(l) .
(4) .
Số phản ứng toả nhiệt là
A. 1. B. 2.
C. 3. D. 4.
Câu 21: Cho hai phương trình nhiệt hóa học sau:
(1)
(2)
Nhận xét đúng là
A. Phản ứng (1) xảy ra thuận lợi hơn.
B. Phản ứng (2) xảy ra thuận lợi hơn.
C. Cả hai phản ứng đều thu nhiệt.
D. Phản ứng (1) toả ra nhiều nhiệt hơn.
Câu 22: Cho phản ứng sau: CaCO3(s) → CaO(s) + CO2(g).
Ở điều kiện chuẩn, biến thiên enthalpy của phản ứng là (Biết nhiệt tạo thành (kJ/mol) của CaCO3, CaO và CO2 lần lượt là -1 207, -635 và -393,5)
A. +178,5 kJ. B. -178,5 kJ.
C. + 357 kJ. D. -357 kJ.
Câu 23: Cho phản ứng sau:
Biết nhiệt tạo thành chuẩn của SO2 là -296,8 kJ/mol. Nhiệt tạo thành chuẩn của SO3 là
A. + 441 kJ/mol. B. -441 kJ/mol.
C. + 414 kJ/mol. D. -414 kJ/mol.
Câu 24: Cho các phản ứng sau:
(1) C(s) + CO2(g) → 2CO(g) = 173,6 kJ
(2) C(s) + H2O(g) → CO(g) + H2(g) = 133,8 kJ
(3) CO(g) + H2O(g) → CO2(g) + H2(g)
Ở 500K, 1 atm, biến thiên enthalpy của phản ứng (3) có giá trị là
A. -39,8 kJ. B. 39,8 kJ.
C. -47,00 kJ. D. 106,7 kJ.
Câu 25: Công thức tính biến thiên enthalpy của phản ứng theo năng lượng liên kết là
A.
B.
C.
D.
Câu 26: Cho phản ứng sau: CH≡CH(g) + H2(g) → CH3-CH3(g).
Năng lượng liên kết (kJ/mol) của H-H là 436, của C-C là 347, của C-H là 414 và của C≡C là 839. Biến thiên enthalpy của phản ứng là
A. +292 kJ. B. -292 kJ.
C. +192 kJ. D. -192 kJ.
Câu 27: Enthalpy tạo thành chuẩn của một đơn chất bền
A. là biến thiên enthalpy chuẩn của phản ứng giữa nguyên tố đó với hydrogen.
B. là biến thiên enthalpy chuẩn của phản ứng giữa nguyên tố đó với oxygen.
C. được xác định từ nhiệt độ nóng chảy của nguyên tố đó.
D. bằng 0.
Câu 28: Các quá trình sau:
a) Nước hóa rắn.
b) Sự tiêu hóa thức ăn.
c) Quá trình chạy của con người.
d) Khí CH4 đốt ở trong lò.
e) Hòa tan KBr vào nước làm cho nước trở nên lạnh.
g) Sulfuric acid đặc khi thêm vào nước làm cho nước nóng lên.
Số quá trình thu nhiệt là
A. 2. B. 3.
C. 4. D. 5.
Phần II: Tự luận (3 điểm)
Câu 1 (1 điểm): Cân bằng phản ứng sau bằng phương pháp thăng bằng electron và chỉ rõ chất oxi hóa, chất khử.
a) Al + HCl AlCl3 + H2.
b) FeS2 + O2 → Fe2O3 + SO2.
Câu 2 (1 điểm): Cho phản ứng đốt cháy ethane:
C2H6 (g) + O2 (g) 2CO2 (g) + 3H2O (l)
Biết:
|
Chất |
C2H6 (g) |
O2 (g) |
CO2 (g) |
H2O (l) |
|
(kJmol-1) |
-84,7 |
0 |
-393,5 |
-285,8 |
a) Tính biến thiên enthalpy chuẩn của phản ứng đốt cháy ethane.
b) Cho biết phản ứng là toả nhiệt hay thu nhiệt, giải thích.
Câu 3 (1 điểm): Cho phản ứng: N2(g) + O2(g) → 2NO(g). Biết năng lượng liên kết trong các phân tử O2, N2 và NO lần lượt là 494 kJ/mol, 945 kJ/mol và 607 kJ/mol. Tính biến thiên enthalpy chuẩn của phản ứng và cho biết vì sao nitrogen chỉ phản ứng với oxygen ở nhiệt độ cao hoặc khi có tia lửa điện.
Hướng dẫn giải - Đề số 1
Phần I: Trắc nghiệm
|
1 - B |
2 - B |
3 - C |
4 - B |
5 - D |
6 - D |
7 - A |
8 - B |
9 - D |
10 - B |
|
11 - A |
12 - C |
13 - A |
14 - C |
15 - B |
16 - A |
17 - B |
18 - C |
19 - D |
20 - C |
|
21 - B |
22 - A |
23 - B |
24 - A |
25 - A |
26 - B |
27 - D |
28 - A |
|
|
Câu 11:
3Fe3O4 + 28HNO3 → 9Fe(NO3)3 + NO + 14H2O
Tổng hệ số: 3 + 28 + 9 + 1 + 14 = 55.
Câu 12:
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O
0,2 → 0,8 mol
Theo phương trình hoá học có cứ 4 mol HCl tham gia phản ứng thì có 2 mol HCl đóng vai trò là chất bị oxi hoá; 2 mol HCl đóng vai trò là chất tạo môi trường.
Þ Vậy cứ 0,8 mol HCl tham gia phản ứng thì có 0,4 mol HCl bị oxi hoá.
Câu 14:
1 tấn quặng chứa 60% FeS2.
Số mol FeS2 trong 1 tấn quặng trên là: 5000 mol
Sơ đồ phản ứng: FeS2 → 2SO2 → 2SO3 → 2H2SO4
Dựa trên sơ đồ có số mol H2SO4 là 2.5000 = 10 000 mol.
Khối lượng H2SO4 thu được là:
98 × 10 000 = 980 000 gam = 980 kg = 0,98 tấn.
Khối lượng H2SO4 98% thu được là: tấn.
Do hiệu suất cả quá trình là 80% nên khối lượng H2SO4 98% thực tế thu được là:
tấn.
Câu 22:
CaCO3(s) → CaO(g) + CO2(g)
<(CaO) + (CO2) - (CaCO3)
= (-635) + (-393,5) – (-1207) = +178,5 (kJ).
Câu 23:
Câu 24:
Lấy phương trình phản ứng (2) trừ phương trình phản ứng (1) được phương trình phản ứng (3).
(3) = (2) - (1)
(3) = 133,8 – 173,6 = - 39,8 (kJ).
Câu 26:
∆rH = 2E(C-H) + E(C≡C) + 2E(H-H) – 6E(C-H) – E(C-C) = (2.414) + 839 + (2.436) – (6.414) – 347 = -292 (kJ).
Phần II: Tự luận
Câu 1:
a)
Chất khử: Al
Chất oxi hóa: HCl
Ta có các quá trình:
Phương trình hoá học:
2Al + 6HCl → 2AlCl3 + 3H2.
b)
Chất khử: FeS2; chất oxi hóa: O2
Phương trình hóa học:
Câu 2:
a) Tổng nhiệt tạo thành các chất đầu là:
= (-84,7.1) = - 84,7 (kJ)
Tổng nhiệt tạo thành các chất sản phẩm là:
= (-393,5.2) + (-285,8.3) = - 1644,4 (kJ)
⇒ Biến thiên enthalpy của phản ứng:
= - 1559,7 (kJ).
b) Phản ứng là toả nhiệt vì
Câu 3:
N2(g) + O2(g) → 2NO(g)
= (945.1 + 494.1) – 607.2 = 225 (kJ).
> 0, phản ứng thu nhiệt.
Tức là 1 mol N2 (g) phản ứng với 1 mol O2 (g) cần cung cấp 225kJ nhiệt lượng
⇒ Nitrogen chỉ phản ứng với oxygen ở nhiệt độ cao hoặc khi có tia lửa điện.