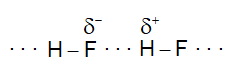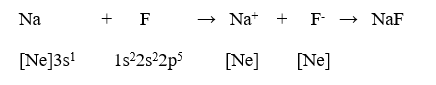Đề cương Học kì 1 Hóa học 10 Kết nối tri thức
I. Kiến thức ôn tập
CHƯƠNG 1: NGUYÊN TỬ
I. Thành phần nguyên tử
Nguyên tử gồm hạt nhân và vỏ electron. Hạt nhân gồm các hạt proton và nơtron, phần vỏ gồm các electron.
| Proton | Nơtron | Electron | |
| Kí hiệu | p | n | e |
| Khối lượng u (đvC) | 1 | 1 | 0,00055 |
| Khối lượng (kg) | 1,6726.10-27 | 1,6748.10-27 | 9,1095.10-31 |
| Điện tích nguyên tố | 1+ | 0 | 1- |
| Điện tích C (Culông) | 1,602.10-19 | 0 | –1,602.10-19 |
● Kết luận:
- Hạt nhân mang điện tích dương, vỏ electron mang điện tích âm
- Tổng số p = số e trong nguyên tử
II. Điện tích và số khối hạt nhân
1. Điện tích hạt nhân
Số đơn vị điện tích hạt nhân (Z) = số proton = số electron
2. Số khối hạt nhân
A = Z + N
3. Nguyên tố hóa học
Là tập hợp các nguyên tử có cùng số điện tích hạt nhân.
Số hiệu nguyên tử (Z) : Z = p = e
Kí hiệu nguyên tử : Trong đó A là số khối nguyên tử, Z là số hiệu nguyên tử, X là ký hiệu hóa học của nguyên tử.
III. Đồng vị, nguyên tử khối trung bình
1. Đồng vị
Là tập hợp các nguyên tử có cùng số proton nhưng khác nhau số nơtron (khác nhau số khối A)
Các đồng vị bền có : với Z < 83 hoặc : với Z ≤ 20.
2. Nguyên tử khối trung bình
Gọi là nguyên tử khối trung bình của một nguyên tố. A1, A2 ... là nguyên tử khối của các đồng vị có % số nguyên tử lần lượt là a%, b%...
Ta có: 
IV. Lớp và phân lớp electron
1. Lớp electron
Trong nguyên tử, mỗi electron có một mức năng lượng nhất định. Các electron có mức năng lượng gần bằng nhau được xếp thành một lớp electron.
Thứ tự và kí hiệu các lớp:
| n | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| Tên lớp | K | L | M | N | O | P | Q |
Tổng số electron trong một lớp là 2n2
| Số thứ tự của lớp electron (n) | 1 | 2 | 3 | 4 |
| Kí hiệu tương ứng của lớp electron | K | L | M | N |
| Số electron tối đa ở lớp | 2 | 8 | 18 | 32 |
2. Phân lớp electron
- Mỗi lớp electron lại được chia thành các phân lớp. Các electron thuộc cùng một phân lớp có mức năng lượng bằng nhau.
- Kí hiệu các phân lớp là các chữ cái thường : s, p, d, f.
- Số phân lớp của một lớp electron bằng số thứ tự của lớp.
Ví dụ : Lớp K (n = 1) chỉ có một phân lớp s.
- Lớp L (n = 2) có 2 phân lớp là s và p.
- Lớp M (n = 3) có 3 phân lớp là s, p, d…
- Số electron tối đa trong một phân lớp : Phân lớp s chứa tối đa 2 electron ; Phân lớp p chứa tối đa 6 electron ; Phân lớp d chứa tối đa 10 electron ; Phân lớp f chứa tối đa 14 electron.
V. Cấu hình electron trong nguyên tử
1. Mức năng lượng
Trật tự mức năng lượng : 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s ...
Mức năng lượng tăng dần.
Cách viết cấu hình electron trong nguyên tử :
- Xác định số electron
- Sắp xếp các electron vào phân lớp theo thứ tự tăng dần mức năng lượng
- Viết electron theo thứ tự các lớp và phân lớp.
Ví dụ : Viết cấu hình electron của Fe (Z = 26)
1s22s22p63s23p64s23d6
Sắp xếp theo mức năng lượng
1s22s22p63s23p63d64s2
Cấu hình electron
CHƯƠNG 2: BẢNG TUẦN HOÀN CÁC NGUYÊN TỐ HÓA HỌC
I. Bảng tuần hoàn các nguyên tố hóa học
1. Nguyên tắc sắp xếp :
- Các nguyên tố được sắp xếp theo chiều tăng dần của điện tích hạt nhân nguyên tử.
- Các nguyên tố có cùng số lớp electron được xếp thành một hàng.
- Các nguyên tố có số electron hóa trị trong nguyên tử như nhau được xếp thành một cột.
● Lưu ý : Electron hóa trị là những electron có khả năng tham gia hình thành liên kết hóa học. Chúng thường nằm ở lớp ngoài cùng hoặc ở cả phân lớp sát lớp ngoài cùng nếu phân lớp đó chưa bão hòa.
2. Cấu tạo của bảng tuần hoàn:
a. Ô nguyên tố : Số thứ tự của ô nguyên tố bằng số hiệu nguyên tử, bằng số đơn vị điện tích hạt nhân và bằng tổng số electron của nguyên tử.
b. Chu kì :
Chu kì là dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron, được xếp theo chiều điện tích hạt nhân tăng dần. Số thứ tự của chu kì bằng số lớp electron của nguyên tử.
Bảng tuần hoàn có 7 chu kì :
- Chu kì nhỏ là các chu kì 1, 2, 3. Mỗi chu kì nhỏ gồm 8 nguyên tố, trừ chu kì 1 chỉ có hai nguyên tố.
- Chu kì lớn là các chu kì 4, 5, 6 ,7. Chu kì 4 và chu kì 5 mỗi chu kì có 18 nguyên tố. Chu kì 6 có 32 nguyên tố.
c. Nhóm :
Nhóm nguyên tố là tập hợp các nguyên tố mà nguyên tử có cấu hình electron tương tự nhau, do đó tính chất hóa học gần giống nhau và được xếp thành một cột.
Nguyên tử các nguyên tố trong cùng một nhóm có số electron hóa trị bằng nhau và bằng số thứ tự của nhóm (trừ một số trường hợp ngoại lệ).
Bảng tuần hoàn có 18 cột được chia thành 8 nhóm A và 8 nhóm B.
- Nhóm A : Gồm 8 nhóm từ IA đến VIIIA, số thứ tự của nhóm bằng số electron hóa trị (số electron ở lớp ngoài cùng), nhóm A gồm các nguyên tố s và p. Nhóm A còn được gọi là các nguyên tố thuộc phân nhóm chính.
- Nhóm B : Gồm 8 nhóm từ IB đến VIIIB, số thứ tự của nhóm B bằng số electron hóa trị (số electron lớp ngoài cùng và số electron của phân lớp d sát lớp ngoài nếu phân lớp đó chưa bão hòa), nhóm B gồm các nguyên tố d và f. Nhóm B còn được gọi là các nguyên tố thuộc phân nhóm phụ.
Nguyên tố s, p, d, f là các nguyên tố có các electron ngoài cùng lần lượt điền vào các phân lớp s, p, d, f.
II. Những tính chất biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân
| Bán kính nguyên tử | Độ âm điện | Năng lượng ion hóa |
Tính kim loại |
Tính phi kim |
Tính axit của oxit và hiđroxit |
Tính bazơ của oxit và hiđroxit | |
|
Trong chu kì (trái phải) |
Giảm dần | Tăng dần | Tăng dần | Giảm dần | Tăng dần | Tăng dần | Giảm dần |
|
Trong nhóm (trên xuống) |
Tăng dần | Giảm dần | Giảm dần | Tăng dần | Giảm dần | Giảm dần | Tăng dần |
Nguyên nhân của sự biến đổi tuần hoàn tính chất của các đơn chất, thành phần và tính chất của các hợp chất của các nguyên tố khi xếp chúng theo chiều tăng của điện tích hạt nhân nguyên tử là sự biến đổi tuần hoàn của số electron lớp ngoài cùng.
- Sự biến đổi về hóa trị của các nguyên tố
Với nguyên tố phi kim R có :
- Oxit cao nhất dạng là : R2On (R có hóa trị cao nhất là n);
- Hợp chất khí với hiđro là : RHm (R có hóa trị là m)
Ta luôn có : m + n = 8
CHƯƠNG 3: LIÊN KẾT HÓA HỌC
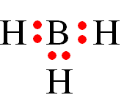
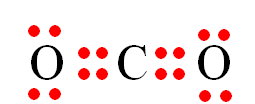
I. Liên kết ion và cộng hóa trị
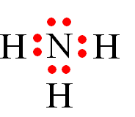
- Liên kết hóa học là sự kết hợp giữa các nguyên tử để tạo thành phân tử hay tinh thể bền vững hơn.
- Các nguyên tử của các nguyên tố có khuynh hướng liên kết với nguyên tử khác tạo thành để đạt được cấu hình electron bền vững giống như khí hiếm (có 2 hoặc 8 electron lớp ngoài cùng).
2. So sánh liên kết ion và liên kết cộng hoá trị
- Giống nhau : Liên kết ion và liên kết cộng hoá trị giống nhau về nguyên nhân hình thành liên kết. Các nguyên tử liên kết với nhau để đạt cấu hình electron bền vững của khí hiếm.
- Khác nhau : Liên kết ion và liên kết cộng hoá trị khác nhau về bản chất liên kết và điều kiện liên kết :
| Loại liên kết | Liên kết ion | Liên kết cộng hoá trị |
| Bản chất | Là lực hút tĩnh điện giữa các ion mang điện tích trái dấu |
Là sự dùng chung các electron - Liên kết cộng hóa trị không phân cực: cặp e liên kết nằm giữa 2 nguyên tử - Liên kết cộng hóa trị phân cực: cặp e liên kết lệch về phía nguyên tử có độ âm điện lớn hơn. |
| Ví dụ | Na+ + Cl- ¾® NaCl |  |
| Điều kiện hình thành liên kết | Các kim loại điển hình liên kết với các phi kim điển hình. Giữa các nguyên tố có bản chất hoá học khác nhau. | Xảy ra giữa các nguyên tố có bản chất hoá học giống nhau hoặc gần giống nhau. Thường xảy ra giữa các nguyên tố phi kim các nhóm 4, 5, 6, 7. |
● Dựa vào giá trị hiệu độ âm điện giữa hai nguyên tử của một liên kết để có thể biết được loại liên kết
| Hiệu độ âm điện () | Loại liên kết |
| 0 ≤ Δx < 0,4 | Liên kết cộng hoá trị không phân cực |
| 0,4 ≤ Δx < 1,7 | Liên kết cộng hoá trị phân cực |
| Δx ≥ 1,7 | Liên kết ion |
● Chú ý : Quy ước này chỉ có ý nghĩa tương đối, có nhiều ngoại lệ và có nhiều thang đo độ âm điện khác nhau. Ví dụ phân tử HF có hiệu độ âm điện > 1,7 nhưng vẫn là hợp chất cộng hóa trị.
VII. Hóa trị và số oxi hóa
1. Hóa trị
- Trong các hợp chất ion: Hóa trị (còn gọi là điện hóa trị) chính bằng điện tích của ion đó.
- Trong hợp chất cộng hóa trị: Hóa trị (cộng hóa trị) chính bằng số liên kết của nguyên tử nguyên tố đó tạo ra được với các nguyên tử khác.
2. Số oxi hóa
– Số oxi hóa của một nguyên tố trong hợp chất là điện tích của nguyên tử nguyên tố đó trong phân tử nếu giả định liên kết trong phân tử là liên kết ion.
– Xác định số oxi hóa của các nguyên tử trong phân tử theo nguyên tắc :
- Số oxi hóa của các đơn chất bằng không.
- Trong hầu hết các hợp chất, số oxi hóa của hiđro là +1, của oxi là –2.
- Số oxi hóa của các ion bằng điện tích của ion đó.
- Tổng số oxi hóa của các nguyên tử trong phân tử bằng không
II. Ma trận
|
Số TT |
Chương/chủ đề |
Nội dung/đơn vị kiến thức |
Mức độ nhận thức |
Tổng số câu |
Tổng số điểm |
||||||||
|
Nhận biết |
Thông hiểu |
Vận dụng |
Vận dụng cao |
||||||||||
|
TL |
TN |
TL |
TN |
TL |
TN |
TL |
TN |
TL |
TN |
||||
|
(1) |
(2) |
(3) |
(4) |
(5) |
(6) |
(7) |
(8) |
(9) |
(10) |
(11) |
(12) |
(13) |
(14) |
|
1 |
Mở đầu |
Mở đầu |
0 |
1 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
1 |
0,25 |
|
2 |
Cấu tạo nguyên tử |
1. Thành phần của nguyên tử |
0 |
1 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
1 |
0,25 |
|
2. Nguyên tố hoá học |
0 |
2 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
2 |
0,50 |
||
|
3. Cấu trúc lớp vỏ electron nguyên tử |
0 |
2 |
0 |
2 |
0 |
0 |
0 |
0 |
0 |
4 |
1,0 |
||
|
3 |
Bảng tuần hoàn các nguyên tố hoá học và định luật tuần hoàn |
1. Cấu tạo của bảng tuần hoàn các nguyên tố hoá học |
0 |
2 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
2 |
0,50 |
|
2. Xu hướng biến đổi một số tính chất của nguyên tử các nguyên tố trong một chu kì và trong một nhóm |
0 |
0 |
0 |
3 |
0 |
0 |
0 |
0 |
0 |
3 |
0,75 |
||
|
3. Xu hướng biến đổi thành phần và một số tính chất của hợp chất trong một chu kì |
0 |
0 |
0 |
1 |
0 |
0 |
0 |
0 |
0 |
1 |
0,25 |
||
|
4. Định luật tuần hoàn và ý nghĩa của bảng tuần hoàn các nguyên tố hoá học |
0 |
1 |
0 |
1 |
0 |
0 |
0 |
0 |
0 |
2 |
0,5 |
||
|
4 |
Liên kết hoá học |
1. Quy tắc octet |
0 |
2 |
0 |
0 |
1 |
0 |
0 |
0 |
1 |
2 |
1,0 |
|
2. Liên kết ion |
0 |
2 |
0 |
0 |
0 |
0 |
1 |
0 |
1 |
2 |
1,5 |
||
|
3. Liên kết cộng hoá trị |
0 |
3 |
0 |
3 |
1 |
0 |
0 |
0 |
1 |
6 |
2,5 |
||
|
4. Liên kết hydrogen và tương tác van der Waals |
0 |
0 |
0 |
2 |
1 |
0 |
0 |
0 |
1 |
2 |
1,0 |
||
|
Tổng số câu |
16 |
12 |
3 |
1 |
4 |
28 |
|||||||
|
Tỉ lệ % |
0 |
40 |
0 |
30 |
20 |
0 |
10 |
0 |
30 |
70 |
|||
|
Tổng hợp chung |
40 |
30 |
20 |
10 |
100 |
10 |
|||||||
III. Câu hỏi ôn tập
1. Trắc nghiệm
Câu 1. Lớp electron thứ 3 có bao nhiêu phân lớp?
A. 1. B. 2. C. 3. D. 4.
Câu 2. Nhóm nguyên tố là tập hợp các nguyên tố mà nguyên tử của chúng có cùng
A. số electron. B. số electron hóa trị.
C. số lớp electron. D. số electron lớp ngoài cùng.
Câu 3. Nguyên tố X thuộc chu kì 4. Vậy số lớp e của X là
A. 6. B. 5. C. 7. D. 4.
Câu 4. Trong một nhóm A (trừ nhóm VIIIA), theo chiều tăng của điện tích hạt nhân nguyên tử,
A. tính kim loại tăng dần, độ âm điện tăng dần.
B. tính phi kim giảm dần, bán kính nguyên tử tăng dần.
C. độ âm điện giảm dần, tính phi kim tăng dần.
D. tính kim loại tăng dần, bán kính nguyên tử giảm dần.
Câu 5. Liên kết ion là liên kết được hình thành bởi
A. sự góp chung các electron độc thân.
B. sự cho – nhận cặp electron hóa trị.
C. lực hút tĩnh điện giữa các ion mang điện trái dấu.
D. lực hút tĩnh điện giữa các ion dương và electron tự do.
Câu 6. Tên gọi của cation (ion dương) Na+ là
A. cation Sodium. B. cation Magnesium. C. cation Aluminum. D. anion Chloride.
Câu 7. Liên kết xichma (s) là liên kết hoá học trong đó trục của orbital liên kết
A. Trùng với đường nối tâm của hai nguyên tử liên kết.
B. Song song với đường nối tâm của hai nguyên tử liên kết.
C. Vuông góc với đường nối tâm của hai nguyên tử liên kết.
D. Tạo với đường nối tâm của hai nguyên tử liên kết một góc 45 o.
Câu 8. Các electron của nguyên tử nguyên tố X được phân bố trên 3 lớp, lớp thứ ba có 4 electron. Số đơn vị điện tích hạt nhân của nguyên tử nguyên tố X là
A. 6. B. 8. C. 14. D. 16.
Câu 9. Nguyên tố X có phân lớp electron ngoài cùng là 3p4. Nhận định nào sai khi nói về X?
A. Hạt nhân nguyên tử của X có 16 proton.
B. Lớp ngoài cùng của nguyên tử nguyên tố X có 6 electron.
C. X là nguyên tố thuộc chu kì 3.
D. X là nguyên tố thuộc nhóm IVA.
Câu 10. Cấu hình electron nguyên tử của 3 nguyên tố X, Y, T lần lượt là: 1s22s22p63s1; 1s22s22p63s23p64s1; 1s22s22p63s23p1. Nếu xếp theo chiều tăng dần tính kim loại thì sự sắp xếp đúng
A. T < X < Y. B. T < Y < Z. C. Y < T < X. D. Y < X < T.
Câu 11. Cho hai nguyên tố X (Z =19); Y (Z = 17). Công thức hợp chất được tạo bởi X và Y và kiểu liên kết là
A. XY, liên kết ion. B. X2Y, liên kết ion.
C. XY, liên kết cộng hóa trị có cực. D. XY2, liên kết cộng hóa trị có cực.
Câu 12. Cho độ âm điện của các nguyên tố H (2,2); O (3,44); C (2,55); Cl (3,16); S (2,58). Hãy cho biết trong các hợp chất sau: H2O, HCl, H2S, CH4, chất nào sau đây chứa cộng hóa trị phân cực?
A. H2O, HCl. B. H2S, HCl. C. CH4, HCl. D. CH4, H2O.
2.Tự luận
Câu 1:Nguyên tử của một nguyên tố X có tổng số hạt cơ bản là 52, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 16 hạt. Tìm số p, e, n và số khối của nguyên tử nguyên tố X.
Câu 2:a/ Viết cấu hình e nguyên tử của các nguyên tố X, Y, T, Q trong các trường hợp sau:
- X có Z = 20.
- Nguyên tử Y có tổng số electron trên phân lớp p là 9.
- Q có Z = 29.
- T có cấu hình electron ion T2-: 1s22s22p6.
b/ Xác định vị trí của nguyên tố X, Q trong bảng tuần hoàn. Giải thích.
c/ Nêu tính chất hóa học cơ bản của nguyên tố X, Y. Giải thích.
Câu 3: Hòa tan hoàn toàn 13,8 gam hỗn hợp A gồm hai kim loại Fe, Al vào 750 ml dung dịch HCl 1,6M (D = 1,1g/ml) thu được 10,08 lít khí (đktc) và dung dịch B.
a/ Tính phần trăm về khối lượng mỗi kim loại trong hỗn hợp A.
b/ Tính nồng độ phần trăm của các chất trong dung dịch B.
c/ Nhỏ từ từ dung dịch KOH 15% vào dung dịch B đến khi thu được kết tủa có khối lượng không đổi, lọc lấy kết tủa đem nung ngoài không khí được m gam chất rắn. Tính khối lượng dung dịch KOH và m?
Câu 4:Biết nguyên tố R ở chu kì 3, nhóm VA trong bảng tuần hoàn.
a) Viết cấu hình electron và xác định số đơn vị điện tích hạt nhân của R?
b) Viết công thức phân tử và công thức cấu tạo của oxit bậc cao, của hiđroxit và hợp chất khí với hiđro của R?
Câu 5: Cân bằng PTHH của các phản ứng oxi hoá- khử sau bằng phương pháp thăng bằng electron (xác định chất khử, chất oxi hoá, quá trình khử, quá trình oxi hóa).
a) Cu + H2SO4 đ, n → CuSO4 + SO2 + H2O
b) Al + HNO3 → Al(NO3)3 + NO + NH4NO3 + H2O
Câu 6: Công thức phân tử của hợp chất khí tạo bởi nguyên tố R và hiđro là RH4. Trong oxit mà R có hoá trị cao nhất thì oxi chiếm 53,3% về khối lượng. Xác định nguyên tố R ?
Câu 1:Cho các nguyên tố: N (Z = 7), Mg (Z = 12), Si (Z = 14), K (Z = 19). Sắp xếp các nguyên tốtheo chiều giảm dần bán kính nguyên tử, tăng dần năng lượng ion hóa thứ1, giảm dần độâm điện từtrái sang phải? Câu 2: Nguyên tửcủa nguyên tốX có cấu hình electron lớp ngoài cùng là ns2np4. Trong hợp chất của nguyên tốX với hiđro, X chiếm 94,12% khối lượng. Oxit cao nhất của X có trong thành phần của oleum, được sửdụng trong sản xuất nhiều hóa chất, thuốc nổ... Xác định công thức oxit cao nhất của X và phần trăm khối lượng của nguyên tốX trong oxit cao nhất?Câu 3:Hai nguyên tốX, Y cùng thuộc 1 nhóm A hoặc B và thuộc hai chu kì liên tiếp. Tổng sốp trong 2 hạt nhân X, Y bằng 32. Xác định vịtrí của X, Y trong BTH? Câu 4: Khi cho 0,78g một kim loại nhóm IA tác dụng với nước thì có 0,224 lít hidro thoát ra (đktc). Xác định tên kim loại đó? (biết MLi= 7, MNa= 23, MK= 39, MRb= 85 , MCs= 133). Câu 5: Aspartame là một chất tạo ngọt nhân tạo, được sửdụng trong một sốloại soda dành cho người ăn kiêng,. Xác định vịtrí của các nguyên tốtạo nên aspartame trong bảng tuần hoàn. Trong các nguyên tốđó, nguyên tốnào có tính phi kim mạnh nhất?
Câu 1:Cho các nguyên tố: N (Z = 7), Mg (Z = 12), Si (Z = 14), K (Z = 19). Sắp xếp các nguyên tốtheo chiều giảm dần bán kính nguyên tử, tăng dần năng lượng ion hóa thứ1, giảm dần độâm điện từtrái sang phải? Câu 2: Nguyên tửcủa nguyên tốX có cấu hình electron lớp ngoài cùng là ns2np4. Trong hợp chất của nguyên tốX với hiđro, X chiếm 94,12% khối lượng. Oxit cao nhất của X có trong thành phần của oleum, được sửdụng trong sản xuất nhiều hóa chất, thuốc nổ... Xác định công thức oxit cao nhất của X và phần trăm khối lượng của nguyên tốX trong oxit cao nhất?Câu 3:Hai nguyên tốX, Y cùng thuộc 1 nhóm A hoặc B và thuộc hai chu kì liên tiếp. Tổng sốp trong 2 hạt nhân X, Y bằng 32. Xác định vịtrí của X, Y trong BTH? Câu 4: Khi cho 0,78g một kim loại nhóm IA tác dụng với nước thì có 0,224 lít hidro thoát ra (đktc). Xác định tên kim loại đó? (biết MLi= 7, MNa= 23, MK= 39, MRb= 85 , MCs= 133). Câu 5: Aspartame là một chất tạo ngọt nhân tạo, được sửdụng trong một sốloại soda dành cho người ăn kiêng,. Xác định vịtrí của các nguyên tốtạo nên aspartame trong bảng tuần hoàn. Trong các nguyên tốđó, nguyên tốnào có tính phi kim mạnh nhất?
IV. Đề thi minh họa
Đề số 1
Phần I: Trắc nghiệm (7 điểm)
Câu 1: Nội dung nào dưới đây thuộc đối tượng nghiên cứu của Hóa học?
A. Sự phân chia của tế bào.
B. Sự hô hấp của sinh vật.
C. Sự chuyển hóa thức ăn trong hệ tiêu hóa.
D. Sự quang hợp của cây xanh.
Câu 2: Nguyên tử chứa các hạt mang điện là
A. proton và hạt nhân.
B. proton và neutron.
C. electron và neutron.
D. proton và electron.
Câu 3: Kí hiệu hóa học của phosphorus (số proton = 15 và số neutron = 16) là
Câu 4: Trong tự nhiên copper (kí hiệu: Cu hay còn gọi là đồng) có hai đồng vị là chiếm 73% và . Nguyên tử khối trung bình của nguyên tố Cu là
A. 63,54.
B. 64,54.
C. 64,00.
D. 64,50.
Câu 5: Lớp thứ M có số phân lớp là
A. 1. B. 2. C. 3. D. 4.
Câu 6: Số electron tối đa chứa trong lớp L là
A. 2. B. 8. C. 18. D. 32.
Câu 7: Cấu hình electron của nguyên tử có Z = 15 là
A. 1s23s22p63s23p2.
B. 1s23s22p63s23p4.
C. 1s23s22p63s23p3.
D. 1s23s22p53s23p4.
Câu 8: Cho các nguyên tố sau: X (Z = 11); Y (Z = 19); T (Z = 20); Q (Z = 17). Nguyên tố phi kim là
A. X (Z = 11).
B. Q (Z = 17).
C. Y (Z = 19).
D. T (Z = 20).
Câu 9: Ion X2+ có 10 electron. Trong bảng tuần hoàn, X thuộc ô số
A. 10. B. 12. C. 8. D. 9.
Câu 10: Nguyên tử nguyên tố X có tổng các electron trên phân lớp p là 7. Vậy X thuộc loại nguyên tố nào sau đây?
A. s. B. d. C. f. D. p.
Câu 11: Nguyên tố X có số hiệu nguyên tử bằng 15. Hydroxide cao nhất của nó có tính chất gì?
A. Acid.
B. Base.
C. Trung tính.
D. Lưỡng tính.
Câu 12: Bán kính nguyên tử của các nguyên tố: Li (Z = 3), O (Z = 8), F (Z = 9), Na (Z = 11) được xếp theo chiều tăng dần từ trái sang phải là
A. F, O, Li, Na.
B. Li, Na, O, F.
C. F, Na, O, Li.
D. F, Li, O, Na.
Câu 13: Nguyên nhân của sự biến đổi tuần hoàn tính chất các nguyên tố là sự biến đổi tuần hoàn
A. của điện tích hạt nhân.
B. của số hiệu nguyên tử.
C. cấu hình electron lớp ngoài cùng của nguyên tử.
D. cấu trúc lớp vỏ electron của nguyên tử.
Câu 14: Độ âm điện của các nguyên tố biến đổi như thế nào trong bảng hệ thống tuần hoàn?
A. Tăng dần trong một chu kì.
B. Giảm dần trong một phân nhóm chính.
C. Biến thiên giống tính phi kim.
D. Tăng dần theo tính kim loại.
Câu 15: Nguyên tố X thuộc chu kì 3, nhóm VIA. Cấu hình electron của nguyên tử X là
A. 1s22s22p4.
B. 1s22s22p63s23p4.
C. 1s22s22p63s23p1.
D. 1s22s22p63s23p3.
Câu 16: Ion Y- có cấu hình electron 1s22s22p63s23p6. Vị trí của Y trong bảng tuần hoàn (chu kì, nhóm) là
A. Chu kì 3, nhóm VIIA.
B. Chu kì 3, nhóm VIA.
C. Chu kì 4, nhóm IA.
D. Chu kì 4, nhóm IIA.
Câu 17: Trong các phản ứng hoá học, các nguyên tử kim loại có khuynh hướng
A. nhận thêm electron.
B. nhận hay nhường electron phụ thuộc vào từng phản ứng cụ thể.
C. nhường electron.
D. nhận hay nhường electron phụ thuộc vào từng kim loại cụ thể.
Câu 18: Công thức được viết dựa trên công thức electron, trong đó mỗi cặp electron chung được thay bằng một gạch nối “–” gọi là
A. công thức cấu tạo thu gọn.
B. công thức Lewis.
C. công thức phân tử.
D. công thức cấu tạo.
Câu 19: Trong các hợp chất sau đây, hợp chất nào có liên kết ion?
A. HCl.
B. H2O.
C. NH3.
D. NaCl.
Câu 20: Cho các phát biểu sau về hợp chất ion:
(1) Không dẫn điện khi nóng chảy.
(2) Dễ hòa tan trong các dung môi hữu cơ.
(3) Có nhiệt độ nóng chảy và nhiệt độ sôi cao.
(4) Khó tan trong nước.
Số phát biểu đúng là
A. 1. B. 2. C. 3. D. 4.
Câu 21: Liên kết được tạo nên giữa hai nguyên tử bằng một hay nhiều cặp electron chung, gọi là
A. liên kết ion.
B. liên kết cộng hoá trị.
C. liên kết kim loại.
D. liên kết hydrogen.
Câu 22: Phát biểu nào sau đây là sai khi nói về liên kết trong phân tử HCl?
A. Phân tử HCl là phân tử phân cực.
B. Các electron liên kết bị hút lệch về một phía nguyên tử chlorine.
C. Cặp electron dùng chung nằm chính giữa hai nguyên tử hydrogen và chlorine.
D. Nguyên tử hydrogen và chlorine liên kết với nhau bằng một liên kết đơn.
Câu 23: Chất nào sau đây có liên kết cộng hóa trị không phân cực?
A. O2.
B. KCl.
C. H2O.
D. HF.
Câu 24: Để đánh giá loại liên kết trong phân tử hợp chất, người ta có thể dựa vào hiệu độ âm điện. Khi hiệu độ âm điện của hai nguyên tử tham gia liên kết ³ 1,7 thì đó là liên kết
A. ion.
B. cộng hoá trị không cực.
C. cộng hoá trị có cực.
D. kim loại.
Câu 25: Cho dãy các chất: N2, H2, NH3, NaCl, HCl, H2O. Số chất trong dãy mà phân tử chỉ chứa liên kết cộng hóa trị phân cực là
A. 3. B. 6. C. 5. D. 4.
Câu 26: Khi hình thành liên kết cộng hóa trị trong phân tử H – F, số electron dùng chung giữa hai nguyên tử H và F là
A. 1.
B. 2.
C. 3.
D. 4.
Câu 27. Tương tác van der Waals
A. làm giảm nhiệt độ nóng chảy, nhưng làm tăng nhiệt độ sôi các chất.
B. làm giảm nhiệt độ nóng chảy và nhiệt độ sôi các chất.
C. làm tăng nhiệt độ nóng chảy và nhiệt độ sôi các chất.
D. không làm thay đổi nhiệt độ nóng chảy và nhiệt độ sôi các chất.
Câu 28: Chọn đáp án đúng nhất. Vì sao HF có nhiệt độ sôi cao hơn hẳn so với HCl, HBr, HI?
A. HF có phân tử khối lớn nhất.
B. HF có liên kết hydrogen.
C. HF có tương tác van der Waals lớn nhất.
D. HF là hợp chất phân cực nhất.
Phần II: Tự luận (3 điểm)
Câu 1 (1 điểm): Vận dụng quy tắc octet để giải thích sự tạo thành liên kết hóa học trong phân tử phosphine (PH3). Biết P (Z = 15); H (Z = 1).
Câu 2 (1 điểm):
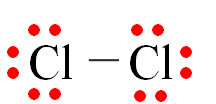
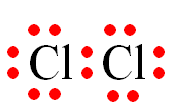
a)Viết công thức electron, công thức Lewis và công thức cấu tạo của chlorine (Cl2).
b) Biểu diễn sự tạo thành liên kết ion trong phân tử NaF.
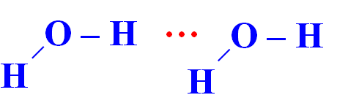
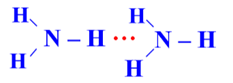
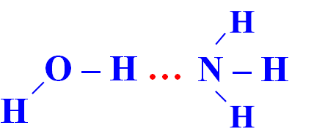
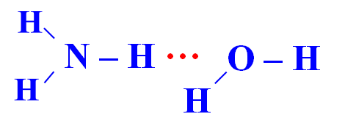
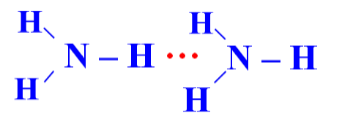
Câu 3 (1 điểm): Amoniac là một hợp chất vô cơ có công thức phân tử NH3. Ở điều kiện tiêu chuẩn, nó là một chất khí, không màu, có mùi khai, tan nhiều trong nước do hình thành liên kết hydrogen với phân tử nước. Trong dung dịch NH3 (hỗn hợp NH3 và H2O) tồn tại bao nhiêu loại liên kết hydrogen?
Đáp án đề 1
Phần I: Trắc nghiệm
|
1 - C |
2 - D |
3 - B |
4 - A |
5 - C |
6 - B |
7 - C |
8 - B |
9 - B |
10 - D |
|
11 - A |
12 - A |
13 - C |
14 - C |
15 - B |
16 - A |
17 - C |
18 - B |
19 - D |
20 - A |
|
21 - B |
22 - C |
23 - A |
24 - A |
25 - A |
26 - B |
27 - C |
28 - B |
Câu 1:
Đáp án đúng là: C
Hóa học nghiên cứu về thành phần, cấu trúc, tính chất, sự biến đổi của chất và các hiện tượng kèm theo.
Vậy nội dung thuộc đối tượng nghiên cứu của Hóa học là: Sự chuyển hóa thức ăn trong hệ tiêu hóa.
Câu 2:
Đáp án đúng là: D
Các hạt mang điện trong nguyên tử là: proton (mang điện tích dương) và electron (mang điện tích âm).
Câu 3:
Đáp án đúng là: B
Số hiệu nguyên tử (Z) = số proton = 15.
Số khối (A) = số proton + số neutron = 15 + 16 = 31.
Kí hiệu hóa học của phosphorus: 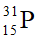
Câu 4:
Đáp án đúng là: A
Áp dụng công thức tính nguyên tử khối trung bình là có:
¯ACu=73.63+(100−73).65100=63,54
Câu 5:
Đáp án đúng là: C
Lớp thứ ba (lớp M, với n = 3) có 3 phân lớp, được kí hiệu là 3s, 3p và 3d.
Câu 6:
Đáp án đúng là: B
Lớp L (n = 2) có số electron tối đa là 2.22 = 8.
Câu 7:
Đáp án đúng là: C
Cấu hình electron của nguyên tử có Z = 15 là: 1s23s22p63s23p3.
Câu 8:
Đáp án đúng là: B
X (Z = 11): [Ne]3s1 Þ Vậy X là kim loại do có 1 electron ở lớp ngoài cùng.
Q (Z = 17): [Ne]3s23p5 Þ Vậy Q là phi kim do có 7 electron ở lớp ngoài cùng.
Y (Z = 19): [Ar]4s1 Þ Vậy Y là kim loại do có 1 electron ở lớp ngoài cùng.
T (Z = 20): [Ar]4s2 Þ Vậy T là kim loại do có 2 electron ở lớp ngoài cùng.
Câu 9:
Đáp án đúng là: B
X → X2+ + 2e
Vậy số electron của X là 10 + 2 = 12.
Trong bảng tuần hoàn X thuộc ô số 12.
Câu 10:
Đáp án đúng là: D
X có tổng các electron trên phân lớp p là 7 nên cấu hình electron của X như sau:
1s22s22p63s23p1.
Vậy X thuộc nguyên tố p.
Câu 11:
Đáp án đúng là: A
Cấu hình electron nguyên tử X: 1s22s22p63s23p3.
X thuộc nhóm VA, công thức hydroxide có dạng: H3XO4, có tính acid.
Câu 12:
Đáp án đúng là: A
Li (Z = 3): 1s22s1 ⇒ Li thuộc chu kì 2, nhóm IA.
O (Z = 8): 1s22s22p4 ⇒ O thuộc chu kì 2, nhóm VIA.
F (Z = 9): 1s22s22p5 ⇒ F thuộc chu kì 2, nhóm VIIA.
Na (Z = 11): 1s22s22p63s1 ⇒ Na thuộc chu kì 3, nhóm IA.
Ta có:
+ Li và Na thuộc cùng nhóm IA, theo quy luật biến đổi bán kính ta có bán kính Na > Li.
+ Li, O, F thuộc cùng chu kì 2, theo quy luật biến đổi bán kính ta có bán kính Li > O > F.
Vậy chiều tăng dần bán kính nguyên tử từ trái sang phải là: F, O, Li, Na.
Câu 13:
Đáp án đúng là: C
Nguyên nhân của sự biến đổi tuần hoàn tính chất các nguyên tố là sự biến đổi tuần hoàn
cấu hình electron lớp ngoài cùng của nguyên tử.
Câu 14:
Đáp án đúng là: C
Độ âm điện là đại lượng đặc trưng cho khả năng hút electron khi hình thành liên kết hóa học.
Độ âm điện của các nguyên tố trong bảng hệ thống tuần hoàn biến đổi tương tự giống tính phi kim.
Câu 15:
Đáp án đúng là: B
X ở chu kì 3 nên có 3 lớp electron;
X ở nhóm VIA nên có 6 electron ở lớp ngoài cùng.
Cấu hình electron của X là: 1s22s22p63s23p4.
Câu 16:
Đáp án đúng là: A
Y + 1e → Y-
Vậy cấu hình electron của Y là: 1s22s22p63s23p5
Vậy Y ở chu kì 3 (do có 3 lớp electron), nhóm VIIA (do 7 electron hóa trị, nguyên tố p).
Câu 17:
Đáp án đúng là: C
Trong phản ứng hóa học các nguyên tử kim loại có khuynh hướng nhường electron để đạt cấu hình electron bền vững giống khí hiếm gần nhất. Số electron nhường thường là 1, 2, 3 electron.
Câu 18:
Đáp án đúng là: B
Công thức được viết dựa trên công thức electron, trong đó mỗi cặp electron chung được thay bằng một gạch nối “–” gọi là công thức Lewis.
Câu 19:
Đáp án đúng là: D
Hợp chất NaCl được hình thành giữa kim loại điển hình và phi kim điển hình nên có liên kết ion.
Câu 20:
Đáp án đúng là: A
Phát biểu (1) sai vì hợp chất ion dẫn điện khi nóng chảy.
Phát biểu (2) sai vì hợp chất ion khó hòa tan trong các dung môi hữu cơ.
Phát biểu (3) đúng hợp chất ion có nhiệt độ nóng chảy và nhiệt độ sôi cao.
Phát biểu (4) sai vì các hợp chất ion dễ tan trong nước.
Câu 21:
Đáp án đúng là: B
Liên kết được tạo nên giữa hai nguyên tử bằng một hay nhiều cặp electron chung, gọi là liên kết cộng hóa trị.
Câu 22:
Đáp án đúng là: C
Phát biểu C sai vì: Liên kết trong phân tử HCl là liên kết cộng hóa trị phân cực, cặp electron dùng chung lệch về phía nguyên tử clo (nguyên tử có độ âm điện lớn hơn).
Câu 23:
Đáp án đúng là: A
Liên kết trong phân tử O2 được hình thành giữa hai nguyên tử giống nhau nên hợp chất này có liên kết cộng hóa trị không phân cực.
Loại B do KCl là hợp chất ion.
Loại C, D do H2O, HF là hợp chất cộng hóa trị phân cực.
Câu 24:
Đáp án đúng là: A
Khi hiệu độ âm điện của hai nguyên tử tham gia liên kết ³ 1,7 thì đó là liên kết ion.
Câu 25:
Đáp án đúng là: A
Số chất có liên kết cộng hóa trị phân cực là NH3, HCl, H2O
Loại N2 và H2 vì là liên kết cộng hóa trị không phân cực (liên kết hình thành giữa các nguyên tử giống nhau).
Loại NaCl vì là liên kết ion (liên kết hình thành giữa kim loại điển hình và phi kim điển hình).
Câu 26:
Đáp án đúng là: B
Mỗi gạch nối biểu thị 1 cặp electron. Vậy số electron dùng chung giữa hai nguyên tử H và F là 2.
Câu 27:
Đáp án đúng là: C
Tương tác van der Waals làm tăng nhiệt độ nóng chảy và nhiệt độ sôi các chất.
Câu 28:
Đáp án đúng là: B
Liên kết hydrogen mạnh mẽ hơn rất nhiều so với tương tác van der Waals
Giữa các phân tử hydrogen fluoride (HF) có liên kết hydrogen:
Còn giữa các phân tử HCl cũng như HBr và HI không có liên kết hydrogen.
Điều này giải thích vì sao nhiệt độ sôi của HF cao hơn hẳn so với HCl, HBr, HI.
Phần II: Tự luận
Câu 1:
P (Z = 15): 1s22s22p63s23p3 Þ P có 5 electron hóa trị cần thêm 3 electron để đạt octet.
H (Z = 1): 1s1 Þ H có 1 electron hóa trị cần thêm 1 electron để đạt octet.
Khi hình thành liên kết, P góp chung 3 electron với 3 electron của 3 H ⇒ Trong PH3, xung quanh P có 8 electron giống khí hiếm Ar còn 3 H đều có 2 electron giống khí hiếm He.
Câu 2:
a)
|
Phân tử |
Công thức electron |
Công thức Lewis |
Công thức cấu tạo |
|
Cl2 |
|
|
Cl – Cl |
b) Biểu diễn sự tạo thành liên kết ion trong phân tử NaF:
Câu 3:
Trong dung dịch NH3 (hỗn hợp NH3 và H2O) tồn tại 4 loại liên kết hydrogen:
|
Kiểu 1 |
Kiểu 2 |
Kiểu 3 |
Kiểu 4 |
|
|
|
|
|
Đề số 2
Phần I: Trắc nghiệm (7 điểm)
Câu 1: Trong các sản phẩm sau, sản phẩm nào không phải là sản phẩm của hóa học?
A. Phân bón hóa học.
B. Thuốc.
C. Dầu gội đầu.
D. Thực phẩm biến đổi gen.
Câu 2: Hạt nhân của nguyên tử nguyên tố A có 24 hạt, trong đó số hạt không mang điện là 12. Số electron trong A là
A. 12. B. 24. C. 13. D. 6.
Câu 3: Số proton và số neutron có trong một nguyên tử aluminium () lần lượt là
A. 13 và 14.
B. 13 và 15.
C. 12 và 14.
D. 13 và 13.
Câu 4: Có những phát biểu sau đây về các đồng vị của một nguyên tố hóa học:
(1) Các đồng vị có tính chất hóa học giống nhau.
(2) Các đồng vị có tính chất vật lí khác nhau.
(3) Các đồng vị có cùng số electron ở vỏ nguyên tử.
(4) Các đồng vị có cùng số proton nhưng khác nhau về số khối.
Trong các phát biểu trên, số phát biểu đúng là
A. 1. B. 2. C. 3. D. 4.
Câu 5: Orbital nguyên tử là
A. đám mây chứa electron có dạng hình cầu.
B. đám mây chứa electron có dạng hình số 8 nổi.
C. khu vực không gian xung quanh hạt nhân mà tại đó xác suất có mặt electron lớn nhất.
D. quỹ đạo chuyển động của electron quay quanh hạt nhân có kích thước năng lượng xác định.
Câu 6: Lớp M có số orbital tối đa bằng
A. 3. B. 4. C. 9. D. 18.
Câu 7: Sự phân bố electron theo ô orbital nào dưới đây là đúng?
A.
B.
C.
D.
Câu 8: Cho các nguyên tố với số hiệu nguyên tử sau: X (Z = 1); Y (Z = 7); E (Z = 12); T (Z = 19). Dãy gồm các nguyên tố kim loại là
A. X, Y, E.
B. X, Y, E, T.
C. E, T.
D. Y, T.
Câu 9: Chu kì 3 của bảng hệ thống tuần hoàn có
A. 2 nguyên tố.
B. 8 nguyên tố.
C. 10 nguyên tố.
D. 18 nguyên tố.
Câu 10: Hạt nhân nguyên tử Y có 15 proton. Vị trí của Y trong bảng tuần hoàn là
A. số thứ tự 15, chu kì 3, nhóm VIIA.
B. số thứ tự 15, chu kì 2, nhóm VA.
C. số thứ tự 15, chu kì 3, nhóm VA.
D. số thứ tự 15, chu kì 4, nhóm VA.
Câu 11: Trong một nhóm, từ trên xuống dưới thì số lớp electron
A. tăng dần.
B. giảm dần.
C. không thay đổi.
D. biến đổi không theo quy luật.
Câu 12: Cấu hình electron nào sau đây ứng với nguyên tố có độ âm điện lớn nhất?
A. 1s22s22p5.
B. 1s22s22p6.
C. 1s22s22p63s1.
D. 1s22s22p63s23p2.
Câu 13: Công thức oxide cao nhất của nguyên tố R (Z = 17) là
A. R2O.
B. R2O3.
C. R2O5.
D. R2O7.
Câu 14: Nguyên tố X ở chu kì 3, nhóm IIA của bảng tuần hoàn. Cấu hình electron của nguyên tử nguyên tố X là
A. 1s²2s²2p6.
B. 1s²2s²2p3s²3p¹.
C. 1s²2s²2p3s³.
D. 1s²2s²2p63s².
Câu 15: Nguyên tố K có số hiệu nguyên tử là 19. Phát biểu nào sau đây về K là không đúng?
A. Số electron ở vỏ nguyên tử của nguyên tố K là 19.
B. Vỏ của nguyên tử K có 4 lớp electron và lớp ngoài cùng có 1 electron.
C. Hạt nhân của nguyên tố K có 19 proton.
D. Nguyên tố K là một phi kim.
Câu 16: Nitrogen (N) là nguyên tố thuộc nhóm VA, chu kì 2 của bảng tuần hoàn. Cho các phát biểu sau:
(a) Nguyên tử N có 2 lớp electron và có 5 electron lớp ngoài cùng.
(b) Công thức oxide cao nhất của N có dạng NO2 và là acidic oxide.
(c) Nguyên tố N có tính phi kim mạnh hơn nguyên tố O (Z = 8).
(d) Hydroxide ứng với oxide cao nhất của N có dạng HNO3 và có tính acid.
Số phát biểu đúng là
A. 1. B. 2. C. 3. D. 4.
Câu 17: Liên kết hóa học là
A. sự kết hợp giữa các hạt cơ bản hình thành nguyên tử bền vững.
B. sự kết hợp giữa các nguyên tử tạo thành phân tử hay tinh thể bền vững hơn.
C. sự kết hợp của các phân tử hình thành các chất bền vững.
D. sự kết hợp của chất tạo thành vật thể bền vững.
Câu 18: Trong các hợp chất, nguyên tử magnesium đã đạt được cấu hình bền của khí hiếm gần nhất bằng cách
A. cho đi 2 electron
B. nhận vào 1 electron
C. cho đi 3 electron.
D. nhận vào 2 electron.
Câu 19: Công thức electron nào sau đây không đủ electron theo quy tắc octet?
A.
B.
C.
D.
Câu 20: Khi nguyên tử nhường hoặc nhận electron sẽ tạo thành
A. phân tử.
B. ion.
C. cation.
D. anion.
Câu 21: Quá trình tạo thành ion Ca2+ nào sau đây là đúng?
A. Ca → Ca2+ + 2e.
B. Ca → Ca2+ + 1e.
C. Ca + 2e → Ca2+.
D. Ca + 1e → Ca2+.
Câu 22: Liên kết ion là loại liên kết hoá học được hình thành nhờ lực hút tĩnh điện giữa các phần tử nào sau đây?
A. Cation và anion.
B. Các anion.
C. Cation và các electron tự do.
D. Electron và hạt nhân nguyên tử.
Câu 23: Phân tử KCl được hình thành do
A.sự kết hợp giữa nguyên tử K và nguyên tử Cl.
B.sự kết hợp giữa ion K+ và ion Cl2-.
C.sự kết hợp giữa ion K- và ion Cl+.
D.sự kết hợp giữa ion K+ và ion Cl-.
Câu 24: Liên kết tạo thành do sự góp chung electron thuộc loại liên kết
A. ion.
B. cộng hóa trị.
C. kim loại.
D. hydrogen.
Câu 25: Dựa vào hiệu độ âm điện giữa 2 nguyên tố, cho biết liên kết trong phân tử nào sau đây là phân cực nhất?
A. HF.
B.HCl.
C.HBr.
D.HI.
Câu 26: Liên kết σ là liên kết được hình thành do
A. sự xen phủ bên của 2 orbital.
B. cặp electron chung.
C. lực hút tĩnh điện giữa hai ion.
D. sự xen phủ trục của hai orbital.
Câu 27: Tương tác van der Waals được hình thành do
A. tương tác tĩnh điện lưỡng cực – lưỡng cực giữa các nguyên tử.
B. tương tác tĩnh điện lưỡng cực – lưỡng cực giữa các phân tử.
C. tương tác tĩnh điện lưỡng cực – lưỡng cực giữa các nguyên tử hay phân tử.
D. lực hút tĩnh điện giữa các phân tử phân cực.
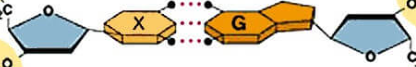
Câu 28: Các liên kết biểu diễn bằng dấu “•••” có vai trò quan trọng trong việc làm bền chuỗi xoắn đôi DNA. Đó là loại liên kết gì?
A. Liên kết ion.
B. Liên kết cộng hoá trị có cực.
C. Liên kết cộng hoá trị không cực.
D. Liên kết hydrogen.
Phần II: Tự luận (3 điểm)
Câu 1 (1 điểm): Vận dụng quy tắc octet để giải thích sự tạo thành liên kết trong phân tử F2. Biết F (Z = 9).
Câu 2 (1 điểm): Biểu diễn sự tạo thành liên kết ion trong phân tử MgO. Biết Mg (Z = 12) và O (Z = 8).
Câu 3 (1 điểm): Trong hai chất ammonia (NH3) và phosphine (PH3), theo em chất nào có nhiệt độ sôi và độ tan trong nước lớn hơn? Giải thích.
Đáp án đề số 2
Phần I: Trắc nghiệm
|
1 - D |
2 - A |
3 - A |
4 - D |
5 - C |
6 - C |
7 - B |
8 - C |
9 - B |
10 - C |
|
11 - A |
12 - A |
13 - D |
14 - D |
15 - D |
16 - B |
17 - B |
18 - A |
19 - B |
20 - B |
|
21 - A |
22 - A |
23 - D |
24 - B |
25 - A |
26 - D |
27 - C |
28 - D |
Câu 1:
Đáp án đúng là: D
Thực phẩm biến đổi gen là sản phẩm của sinh học.
Câu 2:
Đáp án đúng là: A
Số electron = số proton = 24 – 12 = 12 (hạt).
Câu 3:
Đáp án đúng là: A
Số proton = số hiệu nguyên tử (Z) = 13.
Số neutron = A – Z = 27 – 13 = 14.
Câu 4:
Đáp án đúng là: D
Cả 4 phát biểu đều đúng.
Câu 5:
Đáp án đúng là: C
Orbital nguyên tử là khu vực không gian xung quanh hạt nhân mà tại đó xác suất có mặt electron lớn nhất.
Câu 6:
Đáp án đúng là: C
Lớp M (n = 3) có số orbital tối đa là n2 = 32 = 9.
Câu 7:
Đáp án đúng là: B
Trường hợp A, D sai vì 2 electron trong cùng một ô AO phải có chiều tự quay ngược nhau.
Trường hợp C sai vì số electron độc thân chưa đạt tối đa.
Câu 8:
Đáp án đúng là: C
X (Z = 1): 1s1 Þ X là phi kim (trường hợp đặc biệt hydrogen).
Y (Z = 7): 1s22s22p3 Þ Y là phi kim (do có 5 electron ở lớp ngoài cùng).
E (Z = 12): 1s22s22p63s2 Þ E là kim loại (do có 2 electron ở lớp ngoài cùng).
T (Z = 19): 1s22s22p63s23p64s1 Þ T là kim loại (do có 1 electron ở lớp ngoài cùng).
Câu 9:
Đáp án đúng là: B
Chu kì 3 của bảng hệ thống tuần hoàn có 8 nguyên tố.
Câu 10:
Đáp án đúng là: C
Cấu hình electron nguyên tử Y: 1s22s22p63s23p3
Vậy Y ở:
+ Ô thứ 15 (Z = E = P = 15)
+ Chu kì 3 (do có 3 lớp electron).
+ Nhóm VA (do 5 electron hóa trị, nguyên tố p).
Câu 11:
Đáp án đúng là: A
Trong một nhóm, từ trên xuống dưới thì số lớp electrontăng dần.
Câu 12:
Đáp án đúng là: A
Nguyên tố có độ âm điện lớn nhất là F (Z = 9), có cấu hình electron: 1s22s22p5.
Câu 13:
Đáp án đúng là: D
Cấu hình electron nguyên tử R là: 1s22s22p63s23p5.
Vậy R thuộc nhóm VIIA, công thức oxide cao nhất của R là: R2O7.
Câu 14:
Đáp án đúng là: D
X ở chu kì 3 nên có 3 lớp electron.
X ở nhóm IIA nên có 2 electron ở lớp ngoài cùng.
Cấu hình electron của nguyên tử nguyên tố X: 1s²2s²2p63s².
Câu 15:
Đáp án đúng là: D
Phát biểu A và C đúng vì số electron = số proton = số hiệu nguyên tử = 19.
Phát biểu B đúng vì cấu hình electron của K là: 1s22s22p63s23p64s1 Þ K có 4 lớp electron, lớp ngoài cùng có 1 electron.
Phát biểu D sai vì K là kim loại.
Câu 16:
Đáp án đúng là: B
Các phát biểu đúng:a, d.
Ta có cấu hình electron N (Z = 7): 1s22s22p3
(b) sai vì công thức oxide cao nhất của N có dạng N2O5.
(c) Sai vì N và O cùng chu kì. Trong cùng chu kì theo chiều tăng dần của điện tích hạt nhân tính phi kim tăng dần nên tính phi kim O mạnh hơn N.
Câu 17:
Đáp án đúng là: B
Liên kết hóa học là sự kết hợp giữa các nguyên tử tạo thành phân tử hay tinh thể bền vững hơn.
Câu 18:
Đáp án đúng là: A
Cấu hình electron nguyên tử Mg: 1s22s22p63s2
Mg có 2 electron ở lớp ngoài cùng, có xu hướng nhường đi 2 electron này để đạt được cấu hình electron bền vững của khí hiếm gần nhất.
Câu 19:
Đáp án đúng là: B
Trong công thức 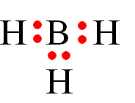
Câu 20:
Đáp án đúng là: B
Khi nguyên tử nhường hoặc nhận electron sẽ tạo thànhion.
Câu 21:
Đáp án đúng là: A
Ca (Z = 20): [Ar]4s2
Ca có 2 electron ở lớp ngoài cùng, có xu hướng nhường 2 electron này để đạt được cấu hình electron bền vững của khí hiếm.
Ca → Ca2+ + 2e.
Câu 22:
Đáp án đúng là: A
Liên kết ion là loại liên kết hoá học được hình thành nhờ lực hút tĩnh điện giữa cation và anion.
Câu 23:
Đáp án đúng là: D
Phân tử KCl được hình thành dosự kết hợp giữa ion K+ và ion Cl-.
Câu 24:
Đáp án đúng là: B
Liên kết tạo thành do sự góp chung electron thuộc loại liên kếtcộng hóa trị.
Câu 25:
Đáp án đúng là: A
Độ âm điện của: F > Cl > Br > I nên liên kết trong phân tử HF là phân cực nhất.
Câu 26:
Đáp án đúng là: D
Liên kết σ là liên kết được hình thành dosự xen phủ trục của hai orbital.
Câu 27:
Đáp án đúng là: C
Tương tác van der Waals được hình thành dotương tác tĩnh điện lưỡng cực – lưỡng cực giữa các nguyên tử hay phân tử.
Câu 28:
Đáp án đúng là: D
Liên kết hydrogen thường được biểu diễn bằng dầu “•••”
Phần II: Tự luận
Câu 1:
F (Z = 9): 1s22s22p5.
Khi hình thành liên kết hóa học trong phân tử F2, nguyên tử fluorine có 7 electron hóa trị, mỗi nguyên tử fluorine cần thêm 1 electron để đạt cấu hình electron bão hòa theo quy tắc octet nên mỗi nguyên tử fluorine góp chung 1 electron.
Phân tử F2 được biểu diễn: 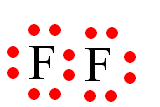
Câu 2:
(Mg→Mg2++2e[Ne]3s2[Ne]O+2e→O2−[He]2s22p4[Ne])⇒Mg2++O2−→MgO
Câu 3:
- Nhiệt độ sôi của NH3 cao hơn nhiệt độ sôi của PH3 do NH3 tạo được liên kết hydrogen liên phân tử còn PH3 thì không:
- NH3 có độ tan trong nước lớn hơn PH3 do NH3 tạo được liên kết hydrogen với H2O:
Đề số 3
Phần I: Trắc nghiệm (7 điểm)
Câu 1: Nội dung nào dưới đây thuộc đối tượng nghiên cứu của hóa học?
A. Sự dao động của con lắc lò xo.
B. Vật chất, năng lượng và sự vận động của chúng.
C. Môi trường sống của ếch.
D. Chất và sự biến đổi của chất.
Câu 2: Nguyên tử sodium có 11 proton, 11 electron và 12 neutron. Số khối của hạt nhân nguyên tử sodium là
A. 22. B. 23. C. 24. D. 34.
Câu 3: Cho các nguyên tử sau: X (Z = 8; A = 16); Y (Z = 9; A = 20); T (Z = 10; A = 20); Q (Z = 8; A = 17). Các nguyên tử thuộc cùng một nguyên tố hóa học là
A. X và Y. B. X và T.
C. X và Q. D. Y và T.
Câu 4: Trong tự nhiên, nguyên tố chlorine có hai đồng vị bền, trong đó đồng vị chiếm 75,77%. Biết nguyên tử khối trung bình của chlorine là 35,48. Số khối của đồng vị còn lại là
A. 36. B. 37. C. 38. D. 39.
Câu 5: Orbital p có dạng
A. hình tròn.
B. hình số tám nổi.
C. hình cầu.
D. hình bầu dục.
Câu 6: Số electron tối đa có trong lớp M là
A. 2. B. 8. C. 18. D. 32.
Câu 7: Phân lớp d có số orbital là
A. 1. B. 3. C. 5. D. 7.
Câu 8: Cấu hình electron nguyên tử Mg (Z = 12) là
A. 1s22s22p63s2.
B. 1s22s22p43s23p2.
C. 1s22s22p53s2.
D. 1s22s22d63s2.
Câu 9: Các nguyên tố hóa học có cùng đặc điểm nào sau đây được xếp thành một cột?
A. Số electron.
B. Số electron hóa trị.
C. Số hiệu nguyên tử.
D. Số lớp electron.
Câu 10: Cho cấu hình electron nguyên tử chlorine: 1s22s22p63s23p5. Chlorine thuộc
A. nguyên tố s.
B. nguyên tố p.
C. nguyên tố d.
D. nguyên tố f.
Câu 11: Cho các nguyên tố: Al (Z = 13); P (Z = 15); S (Z = 16); O (Z = 8). Nguyên tố có bán kính nhỏ nhất là
A. P. B. Al. C. S. D. O.
Câu 12: Số electron hóa trị của nguyên tố X có Z = 20 là
A. 1. B. 2. C. 3. D. 4.
Câu 13: Nguyên tố có tính phi kim mạnh nhất là
A. F. B. Fe. C. Hg. D. Cs.
Câu 14: Trong các oxide dưới đây, acidic oxide là
A. Na2O. B. Al2O3. C. CaO. D. P2O5.
Câu 15: Lưu huỳnh (sulfur) là nguyên tố thuộc nhóm VIA, chu kì 3 của bảng tuần hoàn. Số lớp electron của lưu huỳnh là
A. 3. B. 6. C. 16. C. 9.
Câu 16: Định luật tuần hoàn phát biểu rằng tính chất của các đơn chất cũng như thành phần và tính chất của hợp chất tạo nên từ các nguyên tố biến đổi tuần hoàn theo chiều tăng của
A. điện tích hạt nhân nguyên tử.
B. khối lượng nguyên tử.
C. bán kính nguyên tử.
D. số lớp electron.
Câu 17: Nguyên tố nào sau đây không phải là khí hiếm?
A. Helium.
B. Sodium.
C. Neon.
D. Argon.
Câu 18: Khi nguyên tử oxygen nhận thêm 2 electron thì ion tạo thành có cấu hình electron của nguyên tử nguyên tố nào?
A. F. B. He. C. Ne. D. Ar.
Câu 19: Sơ đồ tạo thành ion nào sau đây là sai?
A. Li → Li+ + 1e.
B. Be → Be2+ + 2e.
C. O + 2e → O2-.
D. Ne + 2e → Ne2-.
Câu 20: Hợp chất ion là
A. CO2. B. CaO. C. H2O. D. SO2.
Câu 21: Liên kết được tạo nên giữa hai nguyên tử bằng một hay nhiều cặp electron chung, gọi là
A. liên kết ion.
B. liên kết cộng hoá trị.
C. liên kết kim loại.
D. liên kết hydrogen.
Câu 22: Cho dãy các chất: N2, H2, NH3, NaCl, HCl, H2O. Số chất trong dãy mà phân tử chỉ chứa liên kết cộng hóa trị phân cực là
A. 3. B. 6. C. 5. D. 4.
Câu 23: Phát biểu nào sau đây là sai?
A. Các hợp chất cộng hóa trị tồn tại ở trạng thái rắn, lỏng hoặc khí.
B. Các hợp chất cộng hóa trị không cực tan tốt trong các dung môi không cực.
C. Các hợp chất cộng hóa trị tan tốt trong nước.
D. Các hợp chất cộng hóa trị không cực không dẫn điện ở mọi trạng thái.
Câu 24: Cho độ âm điện của C và O lần lượt là 2,55 và 3,44. Liên kết giữa C và O trong phân tử CO2 là
A. liên kết cộng hóa trị không phân cực.
B. liên kết cộng hóa trị phân cực.
C. liên kết ion.
D. liên kết hydrogen.
Câu 25: Số liên kết σ và π có trong phân tử C2H4 lần lượt là
A. 5 và 1.
B. 1 và 1.
C. 2 và 0.
D. 4 và 0.
Câu 26: Dãy các chất nào dưới đây mà tất cả các phân tử đều có liên kết cộng hóa trị không phân cực?
A. O2, H2, N2, H2O.
B. HI, HCl, HBr, HF.
C. MgO, Al2O3, AlCl3, Na2O.
D. Cl2, O2, N2, F2.
Câu 27: Vì sao HF có nhiệt độ sôi cao hơn hẳn so với HCl, HBr, HI?
A. HF có phân tử khối lớn nhất.
B. HF có liên kết hydrogen.
C. HF có tương tác van der Waals lớn nhất.
D. HF là hợp chất phân cực nhất.
Câu 28: Liên kết hydrogen xuất hiện giữa những phân tử cùng loại nào sau đây?
A. C2H6.
B. H2O.
C. CO2.
D. H2S.
Phần II: Tự luận (3 điểm)
Câu 29 (0,5 điểm): Viết cấu hình electron của nguyên tử fluorine và dự đoán khả năng nhường hay nhận electron của nguyên tố fluorine khi tham gia các phản ứng hóa học.
Câu 30 (0,5 điểm): Hãy viết công thức Lewis của phân tử O2. Xác định số electron riêng và dùng chung của nguyên tử O trong phân tử này.
Câu 31 (1 điểm): Hãy giải thích tại sao nhiệt độ sôi của H2O (100 oC) cao hơn đáng kể so với nhiệt độ sôi của H2S (-60,75 oC).
Câu 32 (1 điểm): Mô tả sự tạo thành liên kết ion trong magnesium oxide. Biết Mg (Z = 12); O (Z = 8).
Đề số 4
Phần I: Trắc nghiệm (7 điểm)
Câu 1: Điền từ/ cụm từ thích hợp vào chỗ trống trong câu sau: “Hóa học là ngành khoa học thuộc lĩnh vực … (1) …, nghiên cứu về thành phần, cấu trúc, tính chất, sự biến đổi của các đơn chất, hợp chất và … (2) … đi kèm những quá trình biến đổi đó”.
A. (1) năng lượng; (2) sản phẩm.
B. (1) khoa học tự nhiên; (2) năng lượng.
C. (1) khoa học xã hội; (2) năng lượng.
D. (1) khoa học tự nhiên; (2) sản phẩm.
Câu 2: Trong nguyên tử, loại hạt có khối lượng không đáng kể so với các hạt còn lại là
A. neutron và electron.
B. neutron.
C. electron.
D. proton.
Câu 3: Nguyên tố hóa học là tập hợp các nguyên tử có cùng
A. số proton.
B. khối lượng.
C. số neutron.
D. số khối.
Câu 4: Trong nguyên tử X có 12 proton, 12 electron, 13 neutron. Kí hiệu nguyên tử X là
A. . B.
. C.
. D.
.
Câu 5: Orbial s có dạng
A. hình tròn.
B. hình số tám nổi.
C. hình cầu.
D. hình elip.
Câu 6: Số electron tối đa chứa trong phân lớp d là
A. 14. B. 10. C. 6. D. 2.
Câu 7: Nguyên tử X có tổng số electron ở các phân lớp s là 6 và tổng số electron ở lớp ngoài cùng cũng là 6. Nguyên tử X là
A. O (Z = 8).
B. S (Z = 16).
C. Fe (Z = 26).
D. Cr (Z = 24).
Câu 8: Cấu hình electron nào sau đây là của nguyên tử nguyên tố phi kim?
A. 1s2 2s2 2p5.
B. 1s2 2s2 2p6 3s2 3p1.
C. 1s2 2s2 2p6.
D. 1s2 2s2 2p6 3s2.
Câu 9: Số nguyên tố trong chu kì 2 và chu kì 4 lần lượt là
A. 8 và 18.
B. 8 và 8.
C. 18 và 18.
D. 18 và 32.
Câu 10: Nguyên tố X có số hiệu nguyên tử là 18, vị trí của X trong bảng tuần hoàn là
A. ô 18,chu kì 3, nhóm VIB.
B. ô 18, chu kì 3, nhóm VIIIA.
C. ô 18, chu kì 3, nhóm VIA.
D. ô 18, chu kì 3, nhóm VIIIB.
Câu 11: Bán kính của các nguyên tử 11Na, 19K và 17Cl giảm theo thứ tự là
A. Na > K > Cl.
B. Cl > K > Na.
C. K > Cl > Na.
D. K > Na > Cl.
Câu 12: Trong bảng tuần hoàn, nguyên tố có độ âm điện lớn nhất là
A. H. B. He. C. F. D. Fe.
Câu 13: Trong một chu kì, theo chiều tăng của điện tích hạt nhân nguyên tử,
A. bán kính nguyên tử và độ âm điện đều giảm.
B. bán kính nguyên tử và độ âm điện đều tăng.
C. bán kính nguyên tử tăng, độ âm điện giảm.
D. bán kính nguyên tử giảm, độ âm điện tăng.
Câu 14: Nguyên tố silicon thuộc nhóm IVA trong bảng tuần hoàn. Công thức oxide cao nhất của silicon là
A. SiO. B. SiO2. C. Si2O. D. Si4O.
Câu 15: Hai nguyên tố X và Y đứng kế tiếp nhau trong một chu kì và có tổng số proton trong hai hạt nhân là 25. X và Y thuộc chu kì và nhóm nào trong bảng tuần hoàn?
A. Chu kì 3, các nhóm IIA và IIIA.
B. Chu kì 2, các nhóm IIIA và IVA.
C. Chu kì 3, các nhóm IA và IIA.
D. Chu kì 2, nhóm IIA.
Câu 16: Nguyên tố X thuộc chu kì 3, nhóm IIIA. Cấu hình electron nguyên tử của X là
A. 1s22s22p63s2.
B.1s22s22p63s23p63d3.
C. 1s22s22p63s23p1.
D.1s22s22p63s23p3.
Câu 17: Nguyên tử nào sau đây có lớp electron ngoài cùng bền vững?
A.Na (Z = 11).
B.Cl (Z = 17).
C.Ne (Z = 10).
D.Al (Z = 13).
Câu 18: Nguyên tử aluminium nhường đi 3 electron thì ion tạo thành có cấu hình electron giống với cấu hình electron nguyên tử nguyên tố nào?
A.Sodium (Na).
B. Magnesium (Mg).
C. Silicon (Si).
D. Neon (Ne).
Câu 19: Số electron trong các cation: Na+, Mg2+, Al3+ đều bằng
A. 11. B. 12. C. 10. D. 13.
Câu 20: Tính chất nào dưới đây đúng khi nói về hợp chất ion?
A. Hợp chất ion có nhiệt độ nóng chảy thấp.
B. Hợp chất ion tan tốt trong dung môi không phân cực.
C. Hợp chất ion có cấu trúc tinh thể.
D. Hợp chất ion dẫn điện ở trạng thái rắn.
Câu 21: Chất nào sau đây có liên kết cộng hóa trị không phân cực?
A. F2.
B. KBr.
C. H2O.
D. HCl.
Câu 22: Trong phân tử, các electron chuyển động không ngừng, khi các electron tập trung về một phía sẽ hình thành nên
A. một ion dương.
B. một ion âm.
C. một lưỡng cực tạm thời.
D. một lưỡng cực vĩnh viễn.
Câu 23: Hợp chất nào sau đây không tạo được liên kết hydrogen liên phân tử?
A. NH3.
B. HCl.
C. C2H5OH.
D. H2O.
Câu 24: Trong phân tử HF, nguyên tử hydrogen và fluorine đã lần lượt đạt cấu hình electron bền của các khí hiếm nào dưới đây?
A. Neon và argon.
B. Helium và xenon.
C. Helium và neon.
D. Helium và argon.
Câu 25: Cho giá trị độ âm điện của các nguyên tố: F (3,98); O (3,44); C (2,55); H (2,20); Na (0,93). Hợp chất nào sau đây là hợp chất ion?
A. NaF. B. CO2. C. CH4. D. H2O.
Câu 26: Liên kết π là liên kết được hình thành do
A. sự xen phủ bên của 2 orbital.
B. cặp electron chung.
C. lực hút tĩnh điện giữa hai ion.
D. sự xen phủ trục của hai orbital.
Câu 27: Điều nào sau đây sai khi nói về tính chất của hợp chất cộng hoá trị?
A. Các hợp chất cộng hoá trị có nhiệt độ nóng chảy và nhiệt độ sôi thấp hơn các hợp chất ion.
B. Các hợp chất cộng hoá trị có thể ở thể rắn, lỏng hoặc khí trong điều kiện thường.
C. Các hợp chất cộng hoá trị đều dẫn điện tốt.
D. Các hợp chất cộng hoá trị không phân cực tan được trong dung môi không phân cực.
Câu 28: Trong phân tử ammonia (NH3), số cặp electron chung giữa nguyên tử nitrogen và các nguyên tử hydrogen là
A. 3. B. 2. C. 1. D. 4.
Phần II: Tự luận
Câu 29 (1 điểm):
a) Viết cấu hình electron của nguyên tử chlorine (Z = 17) và dự đoán khả năng nhường hay nhận electron của nguyên tố này khi tham gia các phản ứng hóa học.
b)Hãy viết công thức Lewis của phân tử Cl2. Xác định số electron riêng và dùng chung của nguyên tử Cl trong phân tử này.
Câu 30 (1 điểm): Cho dãy các phân tử: CH4; CO2; CH3OH.
a) Phân tử nào trong dãy có thể tạo liên kết hydrogen? Vì sao?
b) Vẽ sơ đồ biểu diễn liên kết hydrogen giữa các phân tử đó.
Câu 31 (1 điểm): Mô tả sự tạo thành liên kết ion trong phân tử potassium chloride. Biết K (Z = 19); Cl (Z = 17).