Tại sao ở điều kiện thường (25 °C, 1 bar), nitrogen tồn tại ở dạng phân tử N2
212
21/10/2023
Bài 3.8 trang 17 SBT Hóa học 11: Tại sao ở điều kiện thường (25 °C, 1 bar), nitrogen tồn tại ở dạng phân tử N2 trong khi đó phosphorus lại tồn tại ở dạng P4 mà không xảy ra trường hợp ngược lại? Biết:
– Năng lượng liên kết ba N≡N là 941 kJ/mol.
– Năng lượng liên kết ba P≡P là 490 kJ/mol.
– Năng lượng liên kết đơn N-N là 160 kJ/mol.
– Năng lượng liên kết đơn P-P là 209 kJ/mol.
Trả lời
+ Xét 4 nguyên tử P tạo thành:
- Phân tử P4 gồm 4 nguyên tử P liên kết với nhau bằng 6 liên kết đơn P-P.
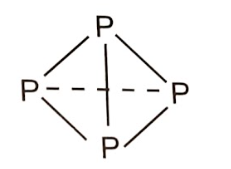
Năng lượng được giải phóng khi tạo một phân tử P4: 6 × 209 = 1254 (kJ).
- Phân tử P2 gồm 2 phân tử P≡P. Năng lượng được giải phóng khi tạo hai phân tử P2: 2 × 490 = 980 (kJ).
→ Phân tử P4 bền hơn P2 nên ở điều kiện thường, phosphorus trắng tồn tại ở dạng phân tử P4.
+ Xét 4 nguyên tử N tạo thành:
- Phân tử N4 gồm 4 nguyên tử N liên kết với nhau bằng 6 liên kết đơn N-N. Năng lượng được giải phóng khi tạo một phân tử N4: 6×160 = 960 (kJ).
- Phân tử N2 gồm 2 phân tử N≡N. Năng lượng được giải phóng khi tạo hai phân tử N2: 2 × 941 = 1882 (kJ).
=> Phân tử N2 bền hơn N4 ở điều kiện thường.
Xem thêm các bài giải SBT Hóa học lớp 11 Chân trời sáng tạo hay, chi tiết khác:
Bài 2: Cân bằng trong dung dịch nước
Ôn tập chương 1
Bài 3: Đơn chất nitrogen
Bài 4: Ammonia và một số hợp chất ammonium
Bài 5: Một số hợp chất với oxygen của nitrogen
Bài 6: Sulfur và sulfur dioxide

